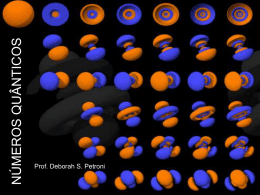
BOHR - 1913 Limitações do modelo de Bohr •Pode explicar adequadamente apenas o espectro de linhas do átomo de hidrogênio. •Os elétrons não são completamente descritos como partículas pequenas. A contribuição de Sommerfeld 1916 – Arnold Sommerfeld. Modelo das órbitas elípticas para o elétron - introdução dos subníveis de energia. Para cada camada eletrônica (n), há uma órbita circular e (n-1) orbitas elípticas. Princípio de Dualidade (Louis De Broglie) A todo elétron em movimento está associada uma onda característica, ou seja, ora o elétron se comporta como uma partícula material e ora como uma onda eletromagnética. As sementes para um novo modelo viriam do conceito de que todas as formas de irradiação eletromagnéticas apresentam as propriedades das ondas e das partículas. Esse conceito levou o oficial da marinha Louis de Broglie (1892-1987) a pensar que as partículas da matéria poderiam apresentar características ondulatórias. Utilizando as equações de Einstein e de Planck, De Broglie mostrou: O momento linear (p), mv, é uma propriedade de partícula, enquanto é uma propriedade ondulatória. Princípio da Incerteza (Werner Heisenberg) Não é possível determinar com precisão a posição e a velocidade de um elétron num mesmo instante, pois os próprios instrumentos de medição interferem na trajetória do elétron. x.p 1 2 x incerteza na localização p incerteza no momento linear ħ h/2 = 1,054x10 -34 J.s A mecânica quântica Resultados experimentais com partículas podem ser explicados por padrões como as ondas. Assim, o conceito mecânico ondulatório de Erwin Schöedinger (1887-1961) produziu outra visão do átomo, que substituiu o modelo de Bohr. Quase simultaneamente, A. Rosemberg chegou à mesma conclusão, apesar de ter trilhado caminhos diferentes. Densidade de probabilidade de encontrar o elétron em torno do núcleo. Onde é mais denso, a probabilidade é maior. Sua posição só pode ser estabelecida no momento do experimento. O ÁTOMO O ÁTOMO PARTÍCULAS SUBATÔMICAS Nome Símbolo Localização Núcleo Carga relativa u +1 Carga efetiva C + 1,6.10-19 Massa relativa u 1 Massa efetiva g ~1,67.10- Próton P Nêutron N Núcleo 0 0 1 ~1,67.10- Elétron e- Eletrosfe ra -1 -1,6.10-19 1/1836 ~9,11.10- 24 24 28 O ÁTOMO O ÁTOMO PARTÍCULAS SUBATÔMICAS Nome Símbolo Localização Núcleo Carga relativa u +1 Carga efetiva C + 1,6.10-19 Massa relativa u 1 Massa efetiva g ~1,67.10- Próton P Nêutron N Núcleo 0 0 1 ~1,67.10- Elétron e- Eletrosfe ra -1 -1,6.10-19 1/1836 ~9,11.10- 24 24 28 Quark Murray Gell-Manm e George Zweig propuseram uma substrutura mais elementar das partículas – o Quark Podemos identificar principalmente duas variedades (sabores) de Quarks: up e down. Quark: Sabor Quark Carga up down charm strange top bottom u d c s t b + 2/3 - 1/3 + 2/3 - 1/3 +2/3 - 1/3 Antiquark u* d* c* s* t* b* Carga Massa -2/3 +1/3 -2/3 +1/3 -2/3 +2/3 0,3 GeV 0,3 GeV 1,5 GeV 0,45 GeV >0,45 GeV 4,9 GeV NÚMERO ATÔMICO É a identificação de um átomo. Corresponde ao número de prótons presentes no núcleo. Z=P OBS.: em um átomo (neutro) o n.º de prótons é igual ao n.º de elétrons. NÚMERO DE MASSA É a somatória de prótons e nêutrons. A=P+N Ex: P=13 Alumínio (Al) N=14 e-=13 Sódio (Na) P=11 N=12 e-=11 Z= Z= 13 A= 11 A= 27 23 MASSA ATÔMICA É a média ponderada das massas atômicas dos átomos isótopos mais abundantes na natureza. Em termos práticos, “é o mesmo” que número de massa (correspondente a massa de carbono12, a ser estudado oportunamente), porém medido em UNIDADES DE MASSA ATÔMICA (u). H=1u C = 12 u N = 14 u O = 16 u MASSA ATÔMICA MASSA MOLECULAR É a massa total de uma molécula (u), obtida pela somatória da massa dos átomos constituintes. Ex: H2O= H2SO4= 18 u 98 u ELEMENTO QUÍMICO É o conjunto de átomos de mesmo número atômico (Z). H2O 3 átomos e 2 elementos CaCO3 5 átomos e 3 elementos ÍONS São átomos ou grupo de átomos com excesso de carga. P ≠ eCÁTIONS (+): perdem elétrons P > eÂNIONS (-): ganham elétrons P < e- ÍONS ÍONS ÁTOMOS ISÓTOPOS São átomos de um mesmo elemento químico que apresentam o mesmo número de prótons e semelhantes propriedades químicas. ISO = mesmo TOPOS = lugar ÁTOMOS ISÓTOPOS Ex:Isótopos do Hidrogênio 1 1H Hidrogênio ou Hidrogênio leve ou prótio 2 Hidrogênio pesado ou deutério H 1 3 Trítio H 1 ÁTOMOS ISÓBAROS São átomos de diferentes elementos químicos que possuem o mesmo número de massa. Ex: 40 K 19 40 Ca 20 ÁTOMOS ISÓTONOS São átomos de diferentes elementos químicos que possuem o mesmo número de nêutrons. Ex: 79 Se 34 80 Br 35 SÉRIE ISOELÊTRONICA São espécies químicas (átomos ou íons) que apresentam a mesma quantidade de elétrons. Ex: -3 N 7 10Ne -2 O 8 +1 Na 11 -1 F 9 +2 Mg 12 ELETROSFERA CAMADAS OU NÍVEIS SUBNÍVEIS Subníveis s p d f Nº máximo de Elétrons 2 6 10 14 ORBITAIS s ORBITAIS p ORBITAIS d NÚMEROS QUÂNTICOS São parâmetros matemáticos, calculados por Paul Dirac, utilizados para determinar a posição de um elétron no átomo. a) N º Quântico Principal (n): Indica a camada (energia). b) N º Quântico Azimutal (l): Indica o subnível. c) N º Quântico Magnético (m): Indica a orbital. d) N º Quântico Spin (s): Indica a rotação de elétrons. NÚMEROS QUÂNTICOS Nome Associado a Número máximo de e– Número quântico principal (n) Energia, raio médio (tamanho) 2.n2 1, 2, 3, ... Número quântico azimutal ou orbital (ℓ) Módulo do momento angular do orbital (forma) 2(2ℓ + 1) 0, 1, 2, ..., n-1 Número quântico magnético (m ou mℓ) Direção do momento angular do orbital 2 0, 1, 2, …, ℓ (2ℓ+1 diferentes valores) Número quântico de spin magnético (S ou ms) Sentido de rotação do e– (estado do spin) -- ½ Valores permitidos NÚMEROS QUÂNTICOS NÚMEROS QUÂNTICOS Elétron mais energético, é aquele que apresenta a maior soma: n+ 6s 6+0 = 6 4f 4+3 = 7 NÚMEROS QUÂNTICOS 5s 5+0 = 5 4s 4+0 = 4 Se dois elétrons apresentarem a mesma soma, terá mais energia aquele que apresentar o maior n. 5s 5+0 = 5 4p 4+1 = 5 PRÍNCIPIO DA EXCLUSÃO DE PAULI Em um mesmo átomo, não existem dois elétrons com quatro números quânticos iguais. Como conseqüência desse princípio, dois elétrons de um mesmo orbital têm spins opostos. Um orbital semicheio contém um elétron desemparelhado. Um orbital cheio contém dois elétrons emparelhados (de spins opostos). Wolfgang Pauli (1900-1958) REGRA DE HUND Ao ser preenchido um subnível, cada orbital desse subnível recebe inicialmente apenas um elétron; somente depois de o último orbital desse subnível ter recebido seu primeiro elétron começa o preenchimento de cada orbital semicheio com o segundo elétron. Friedrich Hermann Hund (1896-1977) ELÉTRON DE DIFERENCIAÇÃO Elétron de maior energia ou elétron de diferenciação é o último elétron distribuído no preenchimento da eletrosfera, de acordo com as regras estudadas. DISTRIBUIÇÃO ELETRÔNICA Diagrama de Linus Pauling DISTRIBUIÇÃO ELETRÔNICA DISTRIBUIÇÃO ELETRÔNICA 2e K (1) 1 s2 8e L (2) 2 s2 2 p6 18e M (3) 3 s2 3 p6 3 d10 32e N (4) 4 s2 4 p6 4 d10 4 f14 32e O (5) 5 s2 5 p6 5 d10 5 f14 18e P (6) 6 s2 6 p6 6 d10 2/8e Q (7) 7 s2 6 p 7 DISTRIBUIÇÃO ELETRÔNICA Hf (Z=72) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 Ordem Energética. 1s2 2s2 2p6 3s2 3p63d10 4s2 4p6 4d10 4f14 5s2 5p6 5d2 6s2 Ordem Geométrica. 2e 8e 18e 32e 10e 2e DISTRIBUIÇÃO ELETRÔNICA Hf (Z=72) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 Ordem Energética. Xe (Z=54) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 Hf (Z=72) [Xe] 6s2 4f14 5d2 Cerne do Gás Nobre. DISTRIBUIÇÃO ELETRÔNICA 2 s 1 26Fe(26e ) K 2 s2 2 p6 3 s2 3 p6 4 s2 3 d6 L M N M 2+(24e-) 1 s2 2 s2 2 p6 Fe 3 s2 3 p6 3 d6 26 3+(23e-) 1 s2 2 s2 2 p6 Fe 3 s2 3 p6 3 d5 26 REFÊRENCIAS BIBLIOGRÁFICAS •Atkins, Peter & Jones, Loretta. Princípios de Química: questionando a vida moderna e o meio ambiente. trad. Ignez Caracelli ...[et al.] . Porto Alegre, Bookman, 2001. •Brown, T.L., Le May, H.E.Jr e Bursten, B.E. Química, ciência central. Rio de Janeiro, LTC, 1999. •Feltre, Ricardo e Yoshinaga, Setsuo. Físico – Química, vol. 2. São Paulo, Moderna, 1974. •Fonseca, Martha R. M. da. Completamente Química, vol. 1. São Paulo, FTD, 2001. •Kotz, John C. e Treichel Jr, Paul. Química e Reações Químicas. Rio de Janeiro, LTC, 1998. •Mahan, Bruce M.e Myers, Rollie J. Química, um curso universitário. São Paulo, Edgard Blücher, 1995. •Masterton, William L., Slowinski, Emil J. e Stanitski, Conrad L. Princípios de Química. Rio de Janeiro, LTC, 1990. •O’Connor, Rod. Introdução à Química. Trad. Elia Tfouni ... [et al]. São Paulo, Harper & Row do Brasil, 1977. •Russel, John Blair. Química Geral, tradução Márcia Guekezian... São Paulo, Makron Books, 1994. •Ziani Suarez, Paulo Anselmo e Mindim, Kleber Carlos. Química Geral. Brasília, Editora UnB, 2003
Baixar