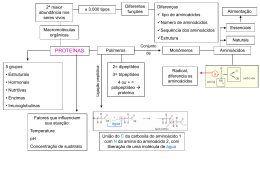
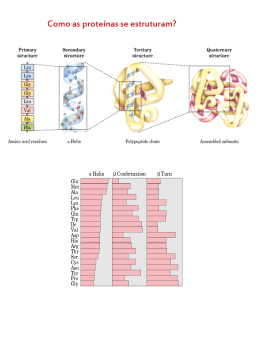
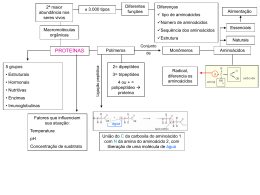
Bioquímica: proteínas •• de transporte – hemoglobina, mioglobina; •• contráteis – actina e miosina; Um dia uma menina de 5 anos me perguntou: “Do que nosso copo é formado, senhor?”. Aí eu respondi: “De células!”. A menina então me retrucou: “Não, senhor, eu quero saber de que coisa nós somos formados”. Só aí eu entendi. A coisa, a matéria-prima, são as proteínas. Elas equivalem aos tijolos de uma casa. As proteínas são os compostos orgânicos mais comuns em um organismo, os mais abundantes depois da água e também os de maior variedade molecular. Estão presentes em todas as estruturas celulares, desde a membrana até o núcleo, compondo as substâncias intercelulares (intersticiais), hormônios, anticorpos etc. As proteínas variam de uma espécie para outra. Quanto maior o parentesco entre duas espécies diferentes, mais parecidas serão suas proteínas em todos os aspectos. As proteínas são, por isso, um dos indicadores evolutivos mais importantes entre os fatores de evidência evolutiva. Nessa ótica, os parentes mais próximos do homem, por apresentarem cerca de 98% das proteínas semelhantes às humanas, são os chimpanzés, assim como o do cão é o lobo. Neste módulo, vamos conhecer um pouco das proteínas e suas funções, como, por exemplo, as fantásticas enzimas. Compreender as proteínas é um bom começo para entender a base de todos os organismos biológicos. •• protetoras – anticorpos, fibrinogênio, citocinas; •• hormônios – insulina, prolactina, FSH, LH...; •• receptoras – as permeases; •• pigmentos – hemoglobina, clorofila; •• hereditariedade – histonas. Composição das proteínas Define-se como proteína a molécula de grande peso molecular formada por dois ou mais aminoácidos. Os aminoácidos são as unidades de uma proteína. Cada um compõe-se por um carbono ( ) no qual se ligam um ácido carboxílico (COOH), uma amina (NH2) e um radical R. É a variação do radical R que os diferencia entre si (é a identidade do aminoácido). Função EM_1S_BIO_003 As proteínas destacam-se pela sua diversidade de funções no corpo. Abaixo estão algumas das mais importantes ações das proteínas: •• catalisadores – enzimas; •• estruturais – colágeno, elastina, queratina etc; •• de reserva – albumina, caseína; Aminoácido com seus grupamentos carboxila e amina e o radical R, que identifica o aminoácido. Características gerais dos aminoácidos Os aminoácidos originam-se a partir de uma substância inicial, o ácido glutâmico, o pai de todos 1 os aminoácidos. Essas reações ocorrem nas células vegetais e, por isso, os vegetais são os produtores por excelência de todos os aminoácidos na natureza. Os aminoácidos são moléculas anfóteras, pois se comportam como ácido (grupo carboxila) ou como base (grupo amina). Durante a formação da proteína, os aminoácidos unem-se entre si por meio de ligações peptídicas. Elas ocorrem entre o grupamento carboxila de um aminoácido com a amina de outro. Dessa ligação há a liberação de uma molécula de água. Os aminoácidos combinam-se de todas as maneiras possíveis, determinando a formação de um número muito grande de proteínas, cuja maioria com certeza ainda não foi descoberta! Saída de H2O – síntese = = = – = O N –C–C – Aminoácido 2 H – OH H R1 – C – C – H – Aminoácido 1 – – – OH R2 – C – C – – NH2 O O – – H NH2 O – NH2 R1 – C – C H R2 Entrada de H2O – hidrólise OH Ligação peptídica Dois aminoácidos 1 e 2 unem-se, formando uma proteína e uma molécula de água (seta superior). A seta inferior indica que a proteína pode reagir com água e, por hidrólise, obtém-se novamente os dois aminoácidos. Só há ligações peptídicas entre dois aminoácidos. Classificação dos aminoácidos Na natureza, existem vários tipos de aminoácido, porém apenas 20 deles encontram-se continuamente nas proteínas e, por isso, são chamados de aminoácidos comuns. Cada proteína apresenta a sua sequência específica de aminoácidos, constituindose na sua própria identidade. As propriedades químicas de cada aminoácido determinam as propriedades das proteínas. A classificação baseia-se na fonte primária dos aminoácidos, ou seja, onde são produzidos. Sabe-se que os vegetais produzem todos eles, mas os animais apenas alguns. Assim, os aminoácidos comuns foram divididos em dois grupos: essenciais e naturais. Essenciais Sintetizados apenas pelos vegetais, são oito: isoleucina, leucina, lisina, metionina, treonina, triptofano, valina e fenilananina. Naturais Produzidos tanto por animais quanto por vegetais. São os doze restantes: alanina, glicina, histidina, tirosina, arginina, ácido aspártico, asparagina, glutamina, serina, prolina, cisteina e ácido glutâmico. Estrutura e classificação das proteínas As proteínas são muito diversificadas e por isso apresentam várias formas de classificação. `` Exemplo: Uma proteína formada por 5 aminoácidos, apresenta 4 LP. Uma outra proteína apresenta 20 ligações peptídicas e contém 21 aminoácidos (n.º de LP + 1). 2 Classificação estrutural As proteínas, em geral, apresentam-se sob a forma globular (esféricas, maioria solúvel em água) e/ou fibrosa (fios, maioria insolúvel em água). Sendo globosas ou fibrosas, as proteínas se organizam em uma ordem padrão, que vai da sequência de aminoácidos até o seu estado mais complexo. São quatro as etapas estruturais que podem incorrer em uma proteína: primária, secundária, terciária e quartenária. Primária Corresponde à sequência dos aminoácidos de uma proteína. É responsável pelas propriedades da proteína, não podendo, por isso, ser alterada. Quando EM_1S_BIO_003 O número de ligações pépticas (LP) em uma proteína é igual ao número de aminoácidos da proteína menos 1. n.º de LP = n.º de aminoácidos – 1 Secundária IESDE Brasil S.A. É a primeira forma espacial, na qual a proteína sofre uma condensação filamentosa (helicoidal), muito parecida com o que ocorre com o DNA. Essa fase também é comum a todas as proteínas. NH2 listra de aminoácidos hidrofóbicos “a” e “d” 0,5nm (A) 11nm por 4 cadeias iguais de mioglobina unidas por um núcleo não-proteico do mineral ferro, chamado radical heme. Primária Secundária Terciária Quartenária IESDE Brasil S.A. isso ocorre, por mutação, como, por exemplo, a perda de um aminoácido, a proteína perde suas características estruturais e funcionais. Essa fase ocorre com todas as proteínas. Sequência das morfologias estruturais de algumas proteínas. A forma primária e secundária é comum a todas as proteínas. A quaternária, apenas em conjugadas, de grande peso molecular. O calor acima de 50°C, pH extremo, a radiação UV e outras formas de radiações fortes podem alterar as estruturas espaciais das proteínas de modo irreversível. A esse fenômeno denomina-se desnaturação. Alguns alimentos, por exemplo, perdem suas qualidades nutricionais por serem expostos a esses agentes físicos, como pelo cozimento, fritura, exposição a céu aberto etc. (B) A sequência de aminoácidos da proteína (estrutura primária) permite que dois ou mais filamentos de proteínas se condensem, fios de proteína (estrutura secundária). Terciária É a segunda forma espacial, em que a condensação admite um formato espacial globoso. As forças responsáveis pela condensação são pontes de hidrogênio, atrações elétricas e pontes de bissulfeto. A sequência de aminoácidos é tão importante nessa fase que a alteração de um deles pode modificar drasticamente toda a morfologia da proteína. Ocorre apenas nas proteínas globosas. As proteínas podem ser simples quando formadas apenas por aminoácidos (colágeno, albumina, histonas...) ou conjugadas, quando apresentarem outra substância além dos aminoácidos (hemoglobina, clorofila, lipoproteínas, ...). As proteínas podem ser chamadas de proteoses (gigantes, com muitos aminoácidos, como a hemoglobina), peptonas (proteínas médias, como a albumina) e peptídeos ou polipeptídios (muito pequenas, com menos de 10 aminoácidos, como no caso de alguns neurotransmissores). EM_1S_BIO_003 Quaternária Ocorre com as proteínas conjugadas de grande porte, com várias cadeias polipeptídicas enoveladas. É o caso clássico da hemoglobina, que é formada 3 Enzimas, os biocatalizadores Complexo ativado com enzima Enzima Energia Energia de ativação de reação catalisada por enzima (Ea) ima Reagentes 1 2 Estágio + inicial Produtos 1 + Estágio final Enz As enzimas talvez sejam as proteínas mais famosas. São especializadas na função de catalisação e, por isso, são chamadas de biocatalisadores, de ação intra e extracelular. 2 Sequência da reação O catalisador é uma substância que modifica a velocidade de uma reação química, acelerando essa reação e economizando a energia utilizada nesse processo todo. A molécula catalisadora não integra o produto de uma reação, ou seja, não perde nenhum átomo para o produto obtido. O gráfico mostra o trabalho da mesma reação anterior, porém com a ação de enzimas. Observa-se uma atenuação do gasto de energia de ativação e, ao final da reação, a enzima sai intacta, pronta para uma outra reação. Ação das enzimas Complexo ativado As enzimas agem sobre substâncias denominadas substrato, formando o composto molecular enzima-substrato. Para cada tipo de substrato existe uma determinada enzima específica, como, por analogia, para cada fechadura há uma chave. É por isso que a união entre uma enzima e um substrato também é chamada de mecanismo chave-fechadura. Reagentes 1 2 Estágio + inicial Estágio final Energia de ativação de reação não catalisada por enzima (Ea) Substratos Produtos 1 2 + Sequência da reação O gráfico mostra o trabalho de uma reação sem a ação de enzimas. Observa-se uma curva elevada de gasto de energia de ativação. As enzimas permitem que as reações ocorram com baixas quantidades dessa energia inicial, reduzindo a liberação de calor. Tente imaginar a digestão de uma boa feijoada sem a ação enzimática. Além de demorar muito, seria produzido um calor insuportável e fatal para o organismo, pois morreríamos cozidos! Com as enzimas digestivas, os nutrientes da feijoada são quebrados mais rápidos, liberando menos calor, e olha que mesmo assim é bastante calor! 4 IESDE Brasil S.A. Energia Enzima C Produto final Na reação, uma enzima (A) em ação de anabolismo (síntese) a partir de 2 substratos (B), origina o produto final (C). Uma outra enzima, ou a mesma, pode pegar esse produto final, agora no papel de substrato, e quebrá-lo, ocorrendo a reação inversa, o catabolismo. Para que ocorra essa especificidade, a enzima apresenta uma região específica para reconhecer e se ligar ao substrato, chamada de sítio de ligação. Apesar da grande especificidade, os substratos muito semelhantes têm a propriedade de alterar sutilmente o sítio de ligação da enzima, aumentando a quantidade de substratos em que a enzima pode agir. Cabe ressaltar que essa região de ligação da enzima é a mais nobre e, se for muito alterada, a enzima perde sua funcionalidade. EM_1S_BIO_003 As reações químicas, para acontecerem, necessitam de um mínimo de energia inicial. Essa quantidade de energia é chamada energia de ativação da reação. Durante a reação há liberação de calor, que na maioria das vezes serve para manter a própria reação ocorrendo. IESDE Brasil S.A. centro ativo a a substratos enzima (ativa) produto A enzima apresenta duas regiões (a) ligação ao substrato, compondo o seu sítio ativo (centro de ligação). Observe, também, a presença da região (b), que serve pra ativar ou inativar uma enzima. Variação da temperatura As enzimas não trabalham em temperaturas extremas, praticamente parando sua atividade abaixo dos 4°C e acima dos 45°C. São exigentes, portanto, de uma temperatura ótima. O aumento gradual da temperatura eleva também a velocidade da reação das enzimas. Mas há um limite, chamado de ponto ótimo (temperatura ótima) de calor, que oscila em torno dos 40°C (ver gráfico). A partir daí, o calor quebra algumas ligações químicas da enzima, provocando a sua desnaturação e inativação. Velocidade da reação Temperatura ótima para enzimas humanas 0 A enzima não integra o produto de sua reação com o substrato. Assim, sua vida útil se mantém por muitas reações. Fatores que influenciam a ação enzimática As enzimas são extremamente exigentes nas condições físico-químicas do meio. Sua velocidade de trabalho pode ser totalmente alterada em função da variabilidade desses fatores. Entre os vários fatores, a temperatura, o pH e a quantidade de substrato são os que mais influenciam o rendimento enzimático. Dependendo do nível de alteração, a enzima pode desnaturar. EM_1S_BIO_003 A velocidade dos metabolismos de um organismo é proporcional ao equilíbrio do meio de trabalho das enzimas. Assim, quanto melhor forem as condições ideais de trabalho das enzimas, melhor será o rendimento metabólico desse organismo. No nosso caso, dormir bem e exercícios físicos são fundamentais para o estabelecimento desse padrão. 20 40 60 80 100 Temperatura (ºC) Variação do pH A alteração do pH pode modificar a estrutura de toda a enzima, do sítio de ligação ou ainda do potencial elétrico da enzima. As enzimas têm o seu pH ótimo. Algumas são basófilas, funcionando em pH alcalino, outras são acidófilas, funcionando em pH ácido, e outras são neutrófilas, trabalhando em pH neutro. `` Exemplo: A ptialina(amilase salivar) é uma enzima que atua em pH ótimo neutro (7); A pepsina (protease do suco gástrico) atua em pH ótimo ácido (2) e a tripsina em pH básico (9). A inversão dos seus meios anula a sua funcionalidade, provocando distúrbios no organismo (ver gráfico). Velocidade da reação ph ótimo para a tripsina, que age no intestino ph ótimo para a pepsina 0 1 2 3 4 5 6 7 8 9 10 pH Quantidade de substrato O aumento da concentração de substrato implica no crescimento do número de enzimas funcionando, por isso, a velocidade da reação enzimática aumenta. Mas chega um momento que a velocidade da reação não aumenta mais, concluindo-se que há um ponto 5 ótimo de concentração de substrato, que acontece quando o número de substrato é igual ao de enzimas. A velocidade começa a diminuir quando o número de substrato é maior que o de enzimas, ou seja, o número de enzimas é insuficiente para quebrar o excesso de substrato em um pequeno intervalo de tempo. ponto ótimo de concentração de substrato Velocidade da reação Inibição competitiva Concentração do substrato Muitas moléculas são semelhantes entre si na sua conformação espacial. Muitas delas podem ter a mesma afinidade com um mesmo substrato, concorrendo com a enzima específica. Quando isso ocorre, todo o metabolismo pode ser alterado. É bom ressaltar que a enzima, na maioria das vezes, continua funcionando, porém os resultados do seu trabalho é que são danosos para o organismo, pois não é o substrato original que está sendo metabolizado e, por isso, o produto final também será outro. O corpo humano possui cerca 100 000 enzimas diferentes, sendo que as células humanas contêm cerca de 2 000 enzimas desse total. Isso significa que cada célula apresenta o seu “pacote” pessoal de enzimas. `` Holoenzimas Algumas enzimas são produzidas de forma inativa ou como zimogênios. Quando ativam-se, formam um conjugado denominado de holoenzimas, composto formado por uma porção proteica e outra não-proteica. A parte proteica é chamada de apoenzima (inativa) e a não-proteica, de coenzima ou cofator. A porção que liga-se à proteína altera sua conformação, expondo os sítios de ativação, tornando a enzima ativa. Caso o ligante seja uma molécula orgânica, é chamado de coenzima ou, se for um composto inorgânico (sais minerais), de cofator. Algumas enzimas requerem tanto uma coenzima quanto um cofator para a sua atividade. 1 2 substratos 6 IESDE Brasil S.A. apoenzima holoenzima (coenzima) cofator complexo enzima – substrato 1 2 produtos Exemplo: A ação competitiva do antibiótico sulfanilamida nas bactérias. Esse antibiótico impede que as bactérias sintetizem o ácido fólico, um tipo de vitamina do complexo B, que se origina do ácido para-aminobenzoico (PABA). Quando a sulfa compete com o PABA, anula todo o processo de produção do ácido fólico. As bactérias morrem! Esse mecanismo é muito parecido com a ação da maioria dos antibióticos do mercado. ácido fólico enzima paba ou enzima sulfa sulfa Inibição não-competitiva ou alostérica Há casos em que a enzima para de funcionar não por inibição, mas por inativação. Isso ocorre quando uma substância se liga em alguma região da enzima que não seja o seu sítio ativo. Essa substância pode ter origem no organismo ou ser externa. É importan- EM_1S_BIO_003 0 Nem sempre as enzimas param de funcionar devido a fatores como temperatura e pH. Muitas moléculas químicas produzidas pelo organismo ou adquiridas podem inibir uma atividade enzimática. É assim, por exemplo, que se explica a ação dos venenos e antibióticos, entre outras substâncias. Esses processos chamam-se de inibição enzimática, que podem ser dos tipos: competitiva e não-competitiva ou alostérica. IESDE Brasil S.A. velocidade máxima Inibição enzimática te ressaltar que, nesse caso de inibição, a enzima desliga completamente, não havendo metabolismo a partir dela. A substância de inativação tem a propriedade de alterar a forma estrutural da enzima, inclusive o seu sítio de ligação. Desse modo, ela perde a capacidade de se ligar ao substrato, caracterizando a sua inativação. Na grande maioria das vezes, é um processo irreversível. Quando a inibição alostérica ocorre com substâncias sintetizadas pelo organismo, todo o processo de inibição ocorre por mecanismo de feedback ou retroalimentação. Trata-se de um fenômeno biológico em que um determinado metabolismo é impedido de ocorrer, a fim de evitar a saturação do sistema. Você verá melhor sobre mecanismos de feedback no assunto sistema endócrino, ao estudar a ação dos hormônios no organismo. centro ativo substratos enzima1 (ativa) produto 1 enzima 1 substrato produto final inibição da enzima 1 pelo produto final IESDE Brasil S.A. Uma outra forma desse tipo de inibição ocorre provocada pelos metais pesados (chumbo, mercúrio, níquel etc.). Eles também não se ligam ao sítio da enzima, mas em outra parte, inativando-a. Popularmente se chama esse processo de envenenamento por metais pesados, muito comum entre os trabalhadores de minas (carvão mineral, ferro, ouro etc.). cérebro. Grandes concentrações desse composto também foram encontradas nos intestinos e ossos esqueléticos. (...) Segundo Andrew Beer e Bem Cockbain, da Universidade de Hertford, em Oxford, a taurina não é incorporada em enzimas e proteínas, mas possui um papel importante no metabolismo dos ácidos da bile. É incorporada com um dos ácidos mais abundantes da bile (o ácido quenodeoxicloico), servindo para emulsionar nos intestinos os lipídios ingeridos na dieta, promovendo a sua digestão. Na dieta, a taurina é encontrada nas proteínas da carne e peixe, mas não em vegetais, grãos ou sementes. Leite humano é rico em taurina, mas o leite bovino não. Vegetarianos com uma dieta desequilibrada em proteína são deficientes em metionina ou cisteína, e podem ter dificuldades de produzir a taurina. A taurina provém proteção às membranas biológicas numa variedade de condições envolvendo peroxidação da membrana lipídica. Isto não parece trazer diretamente um efeito antioxidante, mas um efeito estabilizante às membranas celulares. Ajudando a manter a força e a integridade das membranas celulares, a taurina protege as células de substâncias resultantes da oxidação lipídica. Além da habilidade de proteger tecidos sensíveis à oxidação, tais como a retina, ajuda a manter a estrutura e função das células da visão de reações de peroxidação, causadas pela luz. O efeito de estabilização da taurina também tem sido observado em tecidos do sistema nervoso central, cérebro e coração, onde a taurina é encontrada em altas concentrações. Auxiliando no movimento de entrada e saída de cálcio, magnésio, potássio e sódio das células, a taurina ajuda a gerar os impulsos nervosos. Nas mulheres, o hormônio estradiol deprime a formação de taurina no fígado. (Disponível em: <www.creatina.com.br>). EM_1S_BIO_003 Taurina A taurina é encontrada no sistema nervoso central, nos músculos do esqueleto, e está muito concentrada no cérebro e coração. (...) Já foi determinado que a taurina se encontra em elevadas concentrações nos cérebros em desenvolvimento, caindo logo depois. Pode ser sintetizada no corpo humano a partir de cisteína ou outro composto sulfuroso. A síntese da taurina requer três enzimas dependentes de vitaminas B6. Sua síntese ocorre no fígado e no 1. (PUC-SP) Considere as seguintes afirmativas: I. As proteínas são substâncias de grande importância para os seres vivos. Muitas participam da construção da matéria viva. II. As proteínas chamadas enzimas facilitam reações químicas celulares. III. Os anticorpos, que também são proteínas, funcionam como substância de defesa. 7 Assinale: a) se somente I estiver correta; b) se somente II estiver correta; 1. Dois ou mais ______________ unem-se por ligações ____________, liberando, por essa reação, uma molécula de _________ . O resultado de toda essa reação é a formação de uma proteína. `` Solução: E As proteínas são diversificadas em formas e funções. Na questão, três funções estão citadas: estrutural, catalisadora, na forma de enzimas, e imunológica, como anticorpos. 2. (Unesp) Um técnico de laboratório colocou, separadamente, em seis tubos de ensaio, soluções de amido e soluções de proteína, juntamente com suas respectivas enzimas digestivas. As soluções apresentavam diferentes índices de pH e diferentes temperaturas, de acordo com a tabela seguinte. Tubo pH Temperatura (ºC) I 2 20 II 7 40 III 8 80 IV 2 40 V 8 20 VI 7 8 Passados alguns minutos, observou-se a ocorrência do processo digestivo. A digestão do amido e a digestão da proteína ocorreram, respectivamente, nos tubos: a) I e III b) IV e VI c) II e IV d) IV e V e) III e IV `` Solução: C As enzimas funcionam dentro de condições favoráveis de temperatura e pH. No caso da questão, há duas enzimas: uma neutrófila, que age em pH neutro (7), digerindo o amido, e outra acidófila, que age em pH ácido (2), quebrando a proteína. 8 2. (Elite) A desnaturação de uma proteína ocorre principalmente em qual nível de organização estrutural? Quais as consequências desse fenômeno? 3. (Elite) Sobre a ação das enzimas abaixo, qual letra indica anabolismo e qual é o catabolismo? Justifique sua resposta? a) Enzima Enzima Enzima Enzima b) Enzima Enzima 4. Explique como algumas substâncias químicas conseguem inativar uma enzima. 5. (UC Pel-RS) Assinale a afirmação errada sobre proteínas e aminoácidos: a) Proteínas são polímeros cujos monômeros são aminoácidos. b) A condensação entre duas moléculas de aminoácido produz um polipeptídio. c) Nas proteínas, os aminoácidos unem-se por ligações peptídicas. d) Soluções de proteínas ou aminoácidos têm suas propriedades modificadas pelo pH do meio. e) Aminoácidos podem ser obtidos por hidrólise ácida ou enzimática de proteínas. 6. (PUC-SP) O gráfico seguinte relaciona a velocidade de uma reação química catalisada por enzimas com a temperatura na qual esta reação ocorre. Podemos afirmar que: EM_1S_BIO_003 e) se todas estiverem corretas. IESDE Brasil S.A. d) se I e II estiverem corretas; IESDE Brasil S.A. c) se somente III estiver correta; v t a) a velocidade da reação independe da temperatura; b) existe uma temperatura ótima na qual a velocidade da reação é máxima; A previsão de Berzelius estava correta, e hoje sabemos que o “poder catalítico” mencionado no texto deve-se: a) aos ácidos nucleicos; b) aos carboidratos; c) a velocidade aumenta proporcionalmente à temperatura; c) aos lipídios; d) a velocidade diminui proporcionalmente à temperatura; e) às vitaminas. e) a partir de uma certa temperatura, inverte-se o sentido da reação. 7. (FCC) Uma molécula de hemoglobina é composta de quatro unidades macromoleculares correspondentes a 2 cadeias alfa e 2 beta. Essas cadeias ligam-se de maneira estável, de modo a assumir a configuração tetraédrica da molécula completa. O arranjo descrito explica a: d) às proteínas; 10. (Unifor) Considere as seguintes afirmações abaixo relativas a enzimas. I. São proteínas com função catalisadora. II. Cada enzima pode atuar quimicamente em diferentes substratos. III. Continuam quimicamente intactas após a reação. a) estrutura dos coacervados; IV. Não se alteram com as modificações da temperatura e pH do meio. b) estrutura quaternária das proteínas; São verdadeiras: c) estrutura terciária das proteínas; a) I e III apenas d) a ligações exclusivamente entre aminoácidos; b) II e IV e) há duas corretas. c) I, III e IV 8. (UFRGS) Considere as seguintes alternativas: I. As proteínas são moléculas de grande importância para os organismos – atuam tanto estruturalmente como metabolicamente. d) II, III e IV apenas e) I, II, III e IV 11. Analise as seguintes afirmativas: II. As enzimas são proteínas que atuam como catalisadores biológicos. I. A enzima que digere a lactose também digere a sacarose, pois ambas são dissacarídeos. III. Existem proteínas que atuam como linhas de defesa do organismo e algumas delas são conhecidas como anticorpos. II. O aumento na concentração de substrato de uma enzima é acompanhado por aumento proporcional na velocidade da reação. Quais estão corretas? a) Apenas I III. Mudanças no pH modificam a velocidade da reação química catalisada por uma enzima porque sua estrutura terciária se altera. b) Apenas II a) são verdadeiras I, II e III c) Apenas III b) são verdadeiras apenas I e II d) Apenas II e III c) são verdadeiras apenas I e III e) I, II e III d) é verdadeira apenas I 9. Leia o texto a seguir, escrito por Jöns Jacob Berzelius em 1828. EM_1S_BIO_003 Tudo indica que, no futuro, descobriremos que a capacidade de os organismos vivos produzirem os mais variados tipos de compostos químicos reside no poder catalítico de seus tecidos.” “Existem razões para supor que, nos animais e nas plantas, ocorrem milhares de processos catalíticos nos líquidos do corpo e nos tecidos. e) é verdadeira apenas III 12. (UFES) Se aquecermos uma enzima a 70°C durante uma hora e tentarmos utilizá-la para catalisar uma reação, o resultado será: 9 a) melhor, porque o aumento de temperatura entre 30 e 70°C favorece as reações enzimáticas; 2. (UFFRJ) Observe o esquema das seguintes experiências: b) inalterado, porque as enzimas são muito estáveis; c) nulo, porque as enzimas só exercem a sua ação catalítica nos organismos vivos; tempo d) nulo, porque as enzimas são proteínas e se desnaturam quando aquecidas a essa temperatura; água + fermento água + fermento e) nulo, porque as enzimas só exercem ação catalítica na temperatura ótima para a sua ação. 13. (UFMG-modificada) Os indivíduos albinos não possuem melanina – pigmento responsável pela cor e proteção da pele – e, por isso, são muito sensíveis à luz solar. Neste esquema, está representada parte da via biossintética para a produção desse pigmento: Gene A Enzima1 Enzima1 DOPA tempo água + glicose tempo água + fermento + glicose água + fermento + álcool Explique os resultados verificados, após algum tempo, nos três frascos. MELANINA Com base nesse esquema e em outros conhecimentos sobre o assunto, é correto afirmar que: a) a ausência da Enzima 1 resulta em um aumento da concentração de tirosina; b) uma mutação no gene B não afetará a produção final de melanina; 3. (VESTRIO-RJ) Duas substâncias A e B, ao reagirem à temperatura de 25°C, geram um produto AB. Essa reação é muito lenta. Quando se acrescenta a substância X, que pode ser um catalisador inorgânico ou uma enzima, a velocidade dessa reação aumenta acentuadamente. Para investigar a natureza da substância X realizaram-se vários experimentos para medir a velocidade da reação (concentração do composto AB depois de cinco minutos de reação). Os resultados estão na tabela a seguir: c) a DOPA pode ser suprimida na reação que mesmo assim a melanina será produzida, pois a enzima 2 consegue agir sobre a tirosina; d) as enzimas podem ser invertidas de posição e mesmo assim a melanina será obtida. 1. (UFRN) Uma prática corriqueira na preparação de comida é colocar um pouco de “leite” de mamão ou suco de abacaxi para amaciar a carne. Hoje em dia, os supermercados já vendem um amaciante de carne industrializado. a) Explique o amaciamento da carne promovido pelo componente presente no mamão, no abacaxi ou no amaciante industrializado e compare esse processo com a digestão. b) Se o amaciante, natural ou industrializado, for adicionado durante o cozimento, qual será o efeito sobre a carne? Por quê? Experimento Número Temperatura (°C) Substância ABX Velocidade da Reação I 25 (+) (+) (–) 0,5 II 25 (+) (+) (+) 85,0 III 100 (+) (+) (+) 0,6 IV 25(*) (+) (+) (+) 0,6 (*) No experimento IV, a substância X foi pré-aquecida a 100°C, depois resfriada a 25°C e só então acrescentada ao tubo contendo as substâncias A e B. (+) indica presença e (–) indica ausência. Com base nos resultados da tabela e sabendo que as sustâncias A e B não degradam a 100°C, indique se a substância X é um catalisador inorgânico ou uma enzima. 4. (UFRGS) Na reação abaixo, um grupo carboxila perde uma hidroxila, e um grupo amina perde um hidrogênio. 10 EM_1S_BIO_003 TIROSINA Gene A água + glicose H H a) O = = – = – = – H H – N– C – C – OH CH3 – H O N– C – C – H H – OH H – + – – – N– C – C – – H O – – H CH3 H – – O N– C – C – H H OH + H2O VELO Esta reação é denominada: a) ligação peptídica; TºC b) fosforilação; b) c) glicólise; VELO d) transcrição; e) reação catabólica. 5. (Cesgranrio) “Cerca de 27 milhões de brasileiros têm intolerância ao leite por deficiência na produção de uma enzima do intestino.” TºC c) VELO (Folha de São Paulo, 9 ago. 1998) Sobre a enzima citada no artigo, e as enzimas em geral, podemos afirmar que: a) aumentam a energia de ativação necessária para as reações; TºC d) b) atuam de forma inversamente proporcional ao aumento da temperatura; VELO c) são altamente específicas em função de seu perfil característico; d) são estimuladas pela variação do grau de acidez do meio; e) são consumidas durante o processo, não podendo realizar nova reação do mesmo tipo. 6. Um estudante realizou experimentos sobre a digestão de proteínas. Os resultados estão na tabela a seguir: Substância Temperatu- adicionada ao experira (ºC) mento Velocidade da reação (seg) I 10 (+) 5 II 20 (–) 5 III 30 (+) 15 IV 40 (+) 20 V 50 (+) 0 Experimento EM_1S_BIO_003 (+) = indica a presença TºC e) VELO TºC 7. (Unitau) As ________ são compostos formados por ________unidos (as) por ligações ________ e as _______ são ________ orgânicos, de natureza _______ sensíveis às variações de temperatura. Os termos que corretamente preenchem as lacunas são, respectivamente: a) gorduras – proteínas – peptídicas – enzimas – açúcares – lipídica; b) proteínas – aminoácidos – energéticas – gorduras – compostos – proteica; (–) = indica a ausência c) proteínas – aminoácidos – peptídicas – enzimas – catalisadores – proteica; Qual dos gráficos abaixo melhor traduz os resultados do experimento? d) enzimas – aminoácidos – hídricas – proteínas – catalisadores – lipídica; e) proteínas – açúcares – proteicas – enzimas – açúcares – enzimática. 11 8. Qual das substâncias baixo apresenta exemplos exclusivamente proteicos? a) Colágeno, amilase. b) Glicogênio, hemoglobina. c) Clorofila, quitina. d) Glicerol, lecitina. e) Anticorpo, maltose. 9. (UFRGS) Adrian Srb e Norman Horowitz realizaram um interessante experimento que levou à descoberta da rota de síntese do aminoácido arginina. Nesse experimento, utilizaram sete linhagens mutantes de fungos do gênero Neurospora, incapazes de sintetizar arginina. A partir das observações experimentais, foi montada a seguinte rota metabólica: mutantes 4a7 mutantes 2a3 mutante 1 PRECURSOR → ORNITINA → CITRULINA → ARGININA enzima A enzima B enzima C De acordo com essa rota, é INCORRETO afirmar que: a) os mutantes 4 a 7 podem crescer em um meio suplementado com ornitina, citrulina ou arginina; b) os mutantes 2 e 3 apresentam acúmulo de ornitina; c) os mutantes 2 e 3 apresentam a enzima A inativada; d) o mutante 1 é incapaz de converter citrulina em arginina; e) o mutante 1 não pode crescer em meio suplementado com ornitina ou citrulina. 10. Há países que predominam na produção pecuária bovina. Se houvesse uma boa distribuição de renda nesses países, a população não teria deficiência de proteína animal. a) Cite alguns dos principais rebanhos bovinos do mundo. 12 EM_1S_BIO_003 b) Por que a Índia se destaca com um grande rebanho, mas apresenta uma grande desnutrição proteica entre e a sua população?
Download