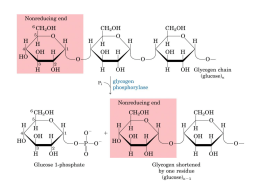
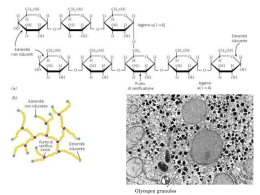
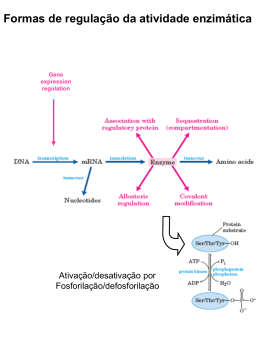
Analisar as vias de síntese e degradação do glicogénio; Identificar as enzimas e outros factores responsáveis pela regulação dessas vias; Explicar os processos de regulação do metabolismo do glicogénio e o seu papel na manutenção da glicémia. Glicogénio • Polímero de moléculas de glicose de tamanho variável. Glicogénio Reserva energética nas células animais, funcionando como alternativa aos lípidos. Existe no citosol de todas as células do organismo, essencialmente no fígado e nos músculos esqueléticos. Libertado para o sangue e tecidos Consumo próprio Importância do glicogénio Permite a acumulação de glicose nas células sem aumentar a pressão osmótica no seu interior. O fígado acumula a glicose sob forma de glicogénio quando há um aumento considerável da glicémia e liberta-a quando há uma diminuição, actuando, assim, como um regulador da glicémia no sangue. Nos músculos esqueléticos, a acumulação do glicogénio acontece durante o repouso e quando a glicémia está elevada. Síntese de glicogénio (Glicogénese) 1. Fosforilação da glicose, originando a glicose -6-P. Hexocinase (músculo) Glucocinase (fígado) Hexocinase Síntese de glicogénio (Glicogénese) 2. Glicose-6-P Glicose-1-P Síntese de glicogénio (Glicogénese) 3. Glc-1-P + UTP UDP-glc + PPi Síntese de glicogénio (Glicogénese) 4. Glicogénio(n) + UDP-glc↔Glicogénio(n+1) + UDP Glicosiltransferase (8 primeiras oses) Glicogénio sintase (restantes oses) Glicogenina (primer) Glicogenina (tirosina 194) Glicosiltransferase Complexo glicogenina – Glicogénio Sintase Adição de + 7 resíduos de glicose Glicogénio v Sintase Glicogenina Continua alongamento da cadeia principal Ramificações Solubilidade e terminais não redutores Velocidade de síntese e degradação Enzima responsável pela formação de ramificações: • (α1 - 4, α1 - 6)-transglucosidase Enzima responsável pelo alongamento das ramificações: • Glicogénio sintase Degradação do glicogénio (Glicogenólise) Neste mecanismo é necessária a acção conjunta de duas enzimas: Glicogénio fosforilase (degradação do glicogénio) Enzima desramificadora (remodulamento do glicogénio) Glicogénio Fosforilase Glicogénio fosforilase Enzima principal na degradação de glicogénio Cliva as ligações α-1,4 pela adição de um ortofosfato (Pi) – fosforólise. Produz glicose-1-fosfato. O fosfato de piridoxal é um cofactor essencial. Enzima desramificadora (amilo-1,6- glucosidase) A enzima desramificadora é uma enzima bifuncional: -Transferase -glucosidase (α 1→6) Transformação da “dextrina limite”, estrutura ramificada, numa estrutura linear. Fosfoglucomutase • Cataliza a isomerização de glicose-1-P a glicose-6-P Regulação do metabolismo do glicogénio Glicogénio Glicogénio Sintase Glicogénio Fosforilase Glucose Regulação do metabolismo do glicogénio Enzimas principais Glicogénio Sintase Glicogénio Fosforilase Fosfatase 1 (PP1) Forma Activa (a) Fosforilase Cinase Forma Activa(a) Fosfatase Fosforilase Cinase Fosfatase Forma Inactiva (b) Reguladas por : -Mecanismos alostéricos - Fosforilação reversível Forma Inactiva (b) Associados a reacções enzimáticas em cadeia como resposta Nota: Fosforilase Cinase – Fosforilação – Degradação do Glicogénio Fosfatase – Desfosforilação – Síntese do Glicogénio Aumento: [Ca2+],[AMP] [Glucose] [Hormonas] Insulina Glucagina Adrenalina Mecanismos de regulação do glicogénio Músculo Fígado Activação da glicogénio fosfatase Activação da glicogénio sintase ↑Ca 2+ ↑ATP ↑AMP ↑Glicose 6-P Activação da glicogénio fosforilase Activação da glicogénio sintase Glucagina ↓Glicose Insulina ↑Adrenalina (cAMP) A glucagina e a adrenalina promovem a degradação do glicogénio: Activam o glicogénio fosforilase inactivam o glicogénio sintase ↑[Ca 2+ ]no citosol activam Fosforilase cinase Degradação do glicogénio A insulina activa uma proteína cinase que vai activar a PP1 Impede a degradação do glicogénio e favorece a sua síntese Fosfatase 1 As alterações na actividade enzimática produzidas pelas proteínas cinases são reconvertidas por proteínas fosfatases PP1. Fosfatase 1 (PP1) Desfosforila o glicogénio sintase b, transformando-o na sua forma activa Acelera a síntese do glicogénio Inactiva a fosforilase cinase e a fosforilase pela desfosforilação destas enzimas Reverte os efeitos da cadeia de fosforilação Diminui a velocidade de degradação do glicogénio Glicogénio Fosforilase É o foco da regulação feita Efectores alostéricos que sinalizam o estado energético da célula Hormonas – fosforilação reversível O músculo utiliza glicose para produzir a sua energia própria Muscular + se ↑AMP - se ↑ ATP - se ↑ [Glicose 6 –P] Glicogénio fosforilase Hepática - se ↑[glicose] insensível [AMP] AMP, ATP Glicose Glicose 6-P Adrenalina Insulina Glucagina A sua activação implica a inactivação da glicogénio sintase Mantém a glicémia Hormonas – fosforilação reversível Exercício Stress Libertação de Adrenalina Leva à formação de cAMP Activa glicogénio fosforilase ↑ Degradação de glicogénio ↑Glicémia ↓ Glicose A adrenalina estimula de forma mais marcante o músculo. O fígado é estimulado pela glucagina. Insulina A insulina estimula a síntese do glicogénio por activar a PP1 Desfosforila o glicogénio sintase b, transformando-o na sua forma activa Acelera a síntese do glicogénio ↓ [Glicose] no sangue Doença Enzima Defeituosa De Von Gierke Glicose 6-fosfatase ou sistema de transporte Órgão Afectado Glicogénio no órgão afectado Características Clínicas Fígado e Rim Quantidade Aumentada Dilatação maciça do fígado; atrasos do desenvolvimento; hipoglicémia grave Insuficiência cardiorespiratória; causa morte(<10 anos) De Pompe A -1,4-Glicosidade Todos Aumento maciço da quantidade De Cori Amilo – 1,6glicosidade Músculo e Fígado Quantidade Aumentada = Von Gierke mas com evolução mais suave De Anderson Enzima Ramificadora Fígado e Baço Quantidade normal Cirrose progressiva do fígado; insuficiência hepática De McArdle Fosforilase Músculo Quantidade aumentada Cãibras musculares dolorosas Figado Quantidade aumentada De Hers Fosforilase = Von Gierke mas com evolução mais suave Bibliografia Berg, J.M.; Stryer, L.; Tymozko, J.L. (2006).Biochemistry. 6ªedição, W. H. Freeman & Company. QUINTAS, Alexandre; PONCES Freire, Ana; HALPERN, Manuel; Bioquímica, Organização molecular da vida, lidel, pp430-438 MURRAY, Robert; GRANNER, Daryl; MAYES, Peter; RODWELL, Victor, Harper’s Ilustrated Biochemistry, twenty-sixth edition, 2003 www.icb.ufmg.br users.med.up.pt http://www2.ufp.pt http://www.portalfarmacia.com.br
Baixar