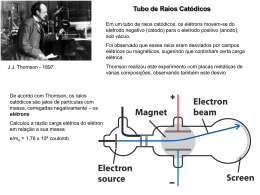
Química Geral – UFAM 1o Semestre – 2014 Estrutura atômica Nascimento da teoria atômica • Sir Joseph John Thomson (1856 – 1940) o Tubo de raios catódicos (William Crookes) ddp 10 ~ 20 kV e p ≈ 10-4 mmHg o Raios catódicos = feixe de partículas com massa e carga diferentes de zero. Razão carga/massa = 1,76x108 C/g o Descoberta do elétron (1897) Modelo elaborado por J. J. Thomson (1904) o plum pudding model, also known as the blueberry muffin model Experimento da Gota de Millikan • Robert Millikan(1868 – 1953) o Medida da carga do elétron. q = 1,6x10-19 C o carga/massa = 1,76x108 C/g (Thomson) Massa = 9,10x10-28 g Radioatividade • Antoine Henri Becquerel (1852 – 1908) o Descoberta (acidental) da Radioatividade do urânio mineral (1896). • Marie e Pierre Curie (1867 – 1934) o Purificação do urânio e descoberta ode elementos radioativos: Po e Ra Radioatividade II • Ernest Rutherford(1871 – 1937) o Descoberta das componentes α, β e γ Partículas: α – carga +2 (núcleo de átomos de He) β – elétrons em alta velocidade γ – não possui massa nem carga Experimento de Rutherford (1911) Massas atômicas • Algumas proporções são observadas nas substâncias. A cada 100 g de H2O, temos 11,1 g de hidrogênio e 88,9 g de oxigênio. 88,9/11,1 ≈ 8 vezes mais massa de oxigênio. Como temos 2 átomos de H, o átomo de oxigênio deve ser 16 vezes mais pesado que o H. Espectrômetro de Massas Tabela periódica moderna
Baixar