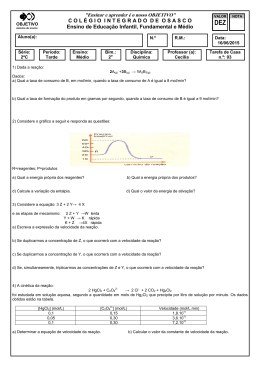
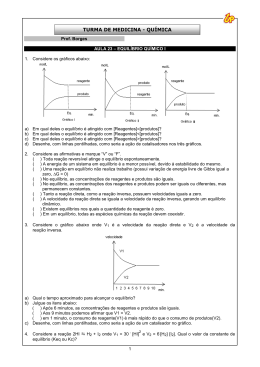
Lei da Velocidade Lei da Velocidade “ A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, para cada temperatura, elevada a expoentes experimentalmente determinados.” Ou seja, Lei da Velocidade da Reação relaciona a rapidez de uma transformação química com as concentrações dos reagentes em quantidade de matéria (mol/L) Lei da Velocidade Por exemplo, considere a reação genérica a seguir: aA + bB → cC + dD Em que: v = velocidade da reação; k = constante que só depende do valor da temperatura; α e β = expoentes determinados experimentalmente (ordem da reação). Reações elementares Ex: Considere a reação elementar, reação que ocorre em uma só etapa: 2CO(g) + O2(g) → 2CO2(g) Escreva a expressão da lei de Velocidade para essa reação. O que ocorre com a velocidade da reação se as concentrações dos dois reagentes forem dobradas? O que ocorrerá com a velocidade se a concentração do CO for reduzida a metade e dobrarmos a concentração do O2? Reações Não Elementares Ex; Considere a reação não elementar: 2NO(g) + 2H2(g) → N2O(g) + 2H2O(g) Ela ocorre em duas etapas: 2NO(g) + H2(g) → N2O(g) + H2O(g) etapa lenta N2O(g) + H2(g) → N2(g) + H2O(g) etapa rápida O que ocorrerá com a velocidade da reaçõa se a concentração dos reagentes forem triplicadas? Reações Não Elementares Quando não sabemos qual é a reação rápida ou qual é a reação lenta em uma equação química? 2A+3B → 3C Reações Não Elementares Ex: Considere a reação A + B + C → D. Foram feitos cinco experimentos usando os reagentes A, B e C e os dados das variações de concentração e de velocidade, em cada experimento , foram anotados no quadro que se segue. Após analisar esses dados, determine a Lei de velocidade e a ordem da reação. Experimento (A) mol/L (B) Mol /L C mol/L V mol/L I 0,5 0,5 0,5 0,20 II 0,5 1,0 0,5 0,20 III 0,5 1,0 1,0 0,80 IV 1,0 0,5 0,5 0,40 V 1,0 1,0 1,0 1,6
Baixar