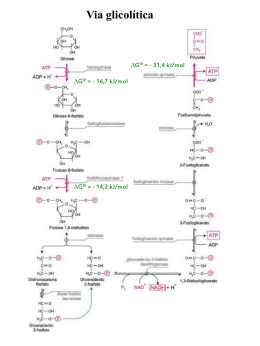
Glicólise GLICÓLISE Glico (açúcar) + lise (quebra) = quebra de glicose (via catabólica, libera energia) Glicose (6C) é degrada por uma cascata de reações enzimáticas para gerar 2 Piruvatos (3C). Energia liberada é conservada na forma de ATP a NADH. São10 etapas enzimáticas catalisadas por enzimas livres no citosol divididas em duas fases: 1ª fase = preparatória (gasto de ATP) 2ª fase = pagamento (ganho energético e formação de 2ATP) Transportador de glicose TRANSPORT AD OR Km par a gl i cose (mM) D ist r i bui ção Car act er íst i cas GLUT 1 1 -2 am pl a, co m alt a con cent r ação no cér ebr o, er i t r óci t os e en dot él i o t r an sp or t ado r co n st i t u t i vo de gl i cose GLUT 2 15 - 20 r i n s, i nt est in o del gado, f ígado e pân cr eas e c él ul as b t r an sp or t ador de bai xa af i ni dade, f u n ci on a com o senso r de gl i cose GLUT 3 10 n eu r ôn i os, pl acen t a t r an spo r t ad or de alt a af i n idade GLUT 4 5 m úscul os esq uel ét ico e car díaco, t eci do adip oso t r an sp or t ado r dep en dent e de i n su l in a GLUT 5 6 - 11 in t est i n o delgado, esper m a, r i m , cér ebr o, ad i póci t os e m úscul o t r an spo r t ador de f r u t ose, af i n i dade m u i t o bai xa p ar a gl i cose Visão geral da glicólise Fase preparatória Fase de pagamento 1ª Reação: Fosforilação da glicose Enzima Hexoquinase Exergônica. Irreversível nas condições celulares!! 2ª Reação: Isomerização da glicose6P (aldose) em frutose6P (cetose) Enzima Fosfohexose Isomerase Mg2+ Fosfohexose Isomerase 3ª Reação: Fosforilação da frutose6P em frutose1,6BP Enzima Fosfofrutoquinase (PFK) Exergônica. Irreversível nas condições celulares!! 4ª Reação: Quebra da frutose1,6BP em duas trioses gliceraldeído3P (GAP) e diidroxicetonaP (DHAP) Enzima: Aldolase 5ª Reação: Reversão da DHAP a GAP Enzima: Triose Fosfato Isomerase Fim da fase preparatória! O que aconteceu até aqui?? Glicose GAP GAP Vamos iniciar a fase de pagamento com a 6ª reação da glicólise 6ª Reação: Oxidação da GAP em 1,3BPglicerato gerando NADH Enzima: GAP Desidrogenase Coenzima NAD+ é reduzida a NADH 7ª Reação: Produção da 1ª molécula de ATP. Enzima: Fosofogliceratoquinase Exergônica. Irreversível nas condições celulares!! Lembrando que partimos de 2 GAP, então temos nesse momento 2 NADH e 2 ATP Reações 6 e 7 são acopladoras de energia. 8ª Reação: Conversão do 3Pglicerato em 2Pglicerato Enzima: Fosfoglicerato mutase 9ª Reação: Desidratação do 2Pglicerato a Fosfoenolpiruvato (PEP) Enzima: Enolase 10ª Reação: Produção da 2ª molécula de ATP Enzima: Piruvato quinase (PK) Exergônica. Irreversível nas condições celulares!! Fim da fase de pagamento, fim da glicólise! O que aconteceu nessa fase? GAP Piruvato GAP GAP Piruvato Balanço final da Via Glicolítica 2 Glicose + 2ATP + 2NAD+ + 4ADP + 2Pi 2 2Piruvatos + 2ADP + 2NADH + H+ + 4ATP + H20 Glicose + 2NAD+ + 2ADP + 2Pi 2Piruvatos + 2NADH + H+ + 2ATP + H20 A glicólise é uma via quase que universal, onde uma molécula de glicose é oxidada a 2 moléculas de piruvato sendo a energia liberada conservada em duas moléculas de ATP e duas moléculas de NADH Todas as enzimas da via glicolítica são citoplasmáticas e seus intermediários são moléculas fosforiladas de 3 ou 6 átomos de carbono Na fase preparatória da glicólise 2 moléculas de ATP são consumidas Na 2ª parte da glicólise a energia liberada e há produção de 2 moléculas de NADH e de 2 ATP para cada triose. Afluentes da glicólise Polissacarídeos – Hidrolisados antes de serem absorvidos Amido Oligossacarídeo Amilase salivar Dissacarídeo Amilase panceática Monossacarídeo Citosol Destino do Piruvato Anaeróbica Anaeróbica Aeróbica Histórico Louis Pasteur 1861: crescimento de leveduras, por grama de glicose, maior na presença do que na ausência de ar. Glicose consumida mais lentamente na presença de ar do que na ausência. Teoria vitalista (“força vital”) Eduard Buchner 1907 : Prêmio Nobel. Derruba a Teoria vitalista – a fermentação ocorre sem vida organizada – Zimases. Harden e Young 1909: isolamento do primeiro intermediário da via glicolítica. 1929: Arthur Harden - Prêmio Nobel Descoberta de um procedimento para acelerar a fermentação: adição de Pi ao meio. Via glicolítica Otto Meyerhoff 1922: Prêmio Nobel Descoberta da correlação entre o consumo de oxigênio e o metabolismo do ácido lático nos músculos de coelho. Ativador: obtido por autólise de levedura. O ativador perde a atividade se aquecido por 1 minuto a 50 ºC e conserva-se bem em gelo. Você pode imaginar a natureza desse ativador? Para você é espantoso que se obtenha um ativador de músculo de coelho a partir de levedura? Fermentação lática Células dos tecidos em condição de hipóxia: músculo, retina, cérebro, eritrócito Fermentação alcoólica A glicose tem um papel central no metabolismo pois é considerada um combustível universal. Alguns tecidos dependem exclusivamente da glicose como fonte de energia. E se não tem GLICOSE?? É necessário resintetizá-la a partir de não carboidratos. Esta via é chamada de gliconeogênese. A gliconeogênese ocorre majoritariamente no fígado, mas também pode ocorrer no cortex renal. A glicose produzida entra na circulação sanguínea e supre os tecidos que necessitam de glicose. O músculo e o cérebro não fazem gliconeogenese pois não têm as enzimas frutose-1,6-bifosfatase e glicose-6-fosfatase. A partir do Piruvato é possível obter glicose por uma inversão quase completa da via glicolítica com exceção das etapas irreversíveis (HK, PFK1 e PK), nesses casos, enzimas distintas irão catalisar a reação (Glicose6 fosfatase, Frutose 16bisfosfatase, Piruvato carboxylase e PEP carboxykinase). Precursores do Piruvato (não carboidrato): Alanina e Lactato Além do piruvato, também é possível obter glicose a partir do Glicerol, produto da degradação lipídios Regulação da Via Glicolítica Já sabemos que todas as vias metabólicas estão sobre intensa regução! Fluxo de metabólitos de uma via metabólica pode ser modulado por: 1. Número de enzimas (por controles transcricionais/traducionais minutos até horas). 2. Mudança da atividade enzimática por: Modificação covalente (via fatores de transcrição) ou ligação a proteína reguladora Regulação alostérica (milisegundos) Seqüestro da enzima ou do substrato em compartimentos diferentes HK PFK1 Pontos de regulação: Reações Irreversíveis PK 1. Hexoquinase Existem 4 isoformas da enzima: I, II, III e IV Hexoquinase muscular – I, II e III: Km < 0,1mM [Glicose] plasmática 5 a 8mM – Enzima funciona sempre em Vmáx Glicose + ATP HK Glicose6P + ADP + H+ Inibidor Hexoquinase Hepática – IV: Km = 10mM Menor afinidade pela glicose.Não é inibida por Glicose6P Hexoquinase IV pode ser inibida pela ligação de uma proteína reguladora. É importante no fígado para garantir que glicose não seja desperdiçada quando estiver abundante, sendo encaminhada para síntese de glicogênio e ácidos graxos. Quando a glicose está escassa, garante que tecidos como cérebro e músculo tenham prioridade no uso. Hexoquinase IV é regulada pelo nível de glicose no sangue: regulação por seqüestro no núcleo celular 2. Fosfofrutoquinase (PFK1) A. Regulação por alosteria Gliconeogênese (PFK1) Glicólise (FBPase-1) Frutose 2,6-bifosfato: presente no fígado e responsável por controlar atividade da glicólise versus gliconeogênese É um efetor positvo da PFK1, produzida pela PFK2. Não é um intermediário da glicólise e não participa de via metabólica específica GLICOSE GLICOSE B. Regulação por ligação covalente GLICOSE (Proteína kinase A) GLICOSE Glucagon = glicose Reg. alostérica (PKA) (PP) Reg. covalente Insulina = glicose Piruvatoquinase (PK) Último passo da via glicolítica. Fluxo de saída. Produz ATP e Piruvato. Também é um tetrâmero apresentando diferentes isoformas em diferentes tecidos Isoforma L (fígado) e isoforma M (músculo). Muitas propriedades em comum: - Frutose 1,6-bisfosfato: ativa - ATP: inibe alostericamente - Alanina: produzida a partir de piruvato, inibe a PK. Diferença: regulação por modificação covalente: fosforilação. Isoforma L (hepática): inativada ao ser fosforilada (estímulo glucagon - glicose) Hexocinase Glicose6 fosfatase Implicações clínicas do metabolismo da glicose Alcoolismo (metabolismo do etanol) Frutosemia Intolerância a lactose Galactosemia Metabolismo do Etanol - O álcool não possui enzimas digestivas, 95% absorção na mucosa intestinal - 80-90% oxidado no fígado, restante distribuído, de 2 a 10% é expelido pela respiração ou excretado na urina (testes toxicológicos, bafômetro) -Enzimas que participam do metabolismo do etanol 1.ADH - Variedade de isoenzimas (classes 1 a 5) As da classe 1 são as mais específicas para o etanol e mais abundantes, citosólicas, não possui mecanismos de regulação. Classe 4 presente na mucosa gástrica = atividade 60% reduzida nas mulheres 2. ADLH – Presente na mitocôndria, deficiência dela considerada fator “anti-alcolismo” frequente em asiáticos. 3. Inativação por CYP2E1 (citocromo P40): inativa também uma série de medicamentos (analgésicos, barbitúricos) Potencializa os efeitos da medicação e do álcool quando ingeridos em conjunto - Ingestão excessivas de bebidas alcoólicas Acidose lática - lactato/piruvato Hipoglicemia - inibição da gliconeogênese Coma alcoólico - efeitos tóxicos do etanol no SNC (parada respirátoria) Tratamento de emergência: infusão intravenosa de glicose e hemodiálise em casos extremos Álcool desidrogenase (ADH) Acetaldeído desidrogenase (ALDH) Frutosemia FRUTOSE: monossacarídeo (sacarose = frutose + glicose) Doença genética autossômica, ausência da enzima frutose-1-fosfato aldolase. Sintomas: Dor abdominal, vômitos, letargia, sudorese, hipoglicemia após ingestão de frutose. Pacientes desenvolvem aversão a doces, sucos, frutas. Tratamento: Exclusão da frutose e sacarose da dieta o que deve ser mantido por toda a vida. Intolerância a lactose LACTOSE: dissacarídeo = galactose + glicose. Enzima lactase Galactosemia GALACTOSE: monossacarídeo (lactose = galactose + glicose). Doença genética autossômica, deficiência em uma das três enzimas do metabolismo da galactose: galactoquinase, galactose–1–P– uridil transferase e uridina– difosfogalactose epimerase. Sintiomas: hepatomegalia, falhas renais, catarata, danos cerebrais, galactosúria, deficiências de aprendizagem, falhas nos ovários. Tratamento: restrição de galactose e lactose na dieta.
Baixar