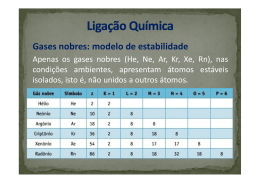
“Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 ATENÇÃO: Não sou o detentor dos direitos e também não tenho a intenção de violá-los de nenhuma imagem, exemplo prático ou material de terceiros que porventura venham a ser utilizados neste ou em qualquer outro material. LIGAÇÕES METÁLICAS E PROPRIEDADES DOS METAIS. No estado sólido, os átomos dos metais se agrupam, de forma geométrica ordenada, dando origem a reticulados cristalinos. Os metais são elementos químicos presentes na Tabela Periódica. Eles apresentam propriedades únicas que se diferem das outras substâncias: ametais, gases, e os demais. Podemos citar algumas dessas propriedades tais como; Alta condutibilidade elétrica Alta condutibilidade térmica Alta maleabilidade (capacidade de transformar em Lâminas) Brilho Metálico Pontos de fusão e ebulição elevados Ductibilidade (capacidade em se transformar em fios) Resistência à tração e choques mecânicos. Os cientistas propuseram um modelo de ligação química que explica grande parte das propriedades apresentadas pelos metais. Essa ligação metálica se baseia no 1 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 fato de que os metais são elementos altamente eletropositivos, tendo, portanto, a tendência de formar cátions. Assim, alguns átomos dos metais perdem os seus elétrons mais externos (da camada de valência) formando cátions. Os elétrons liberados são chamados de semi livres ou de elétrons livres. Esses elétrons não abandonam o cristal, mas possuem mobilidade, transitam livremente, formando uma espécie de “nuvem eletrônica” ou “mar de elétrons” que envolve a estrutura e causa uma força que faz com que os átomos do metal permaneçam unidos. Os cátions formados agrupam-se segundo um arranjo geométrico bem definido, uma estrutura cristalina ou célula unitária, que também pode ser chamada de retículo ou reticulado cristalino. Os reticulados cristalinos mais comuns dentre os metais são os representados a seguir: Esses cátions são estabilizados pelos elétrons livres, pois os cátions podem receber esses elétrons, voltando a ser neutros. Depois eles voltam a perder elétrons e, assim, sucessivamente. A estabilidade da ligação é obtida pelo ganho de energia na formação da ligação envolvendo diversos átomos. 2 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 EXPLICAÇÃO DO PORQUE DE ALGUMAS PROPRIEDADES DOS METAIS; BONS CONDUTORES TÉRMICOS E ELÉTRICOS: Essa teoria da ligação metálica explica muitas propriedades dos metais, por exemplo, os metais são bons condutores térmicos e elétricos devido aos elétrons livres, que permitem o trânsito rápido de calor e eletricidade. ELEVADOS PONTOS DE FUSÃO E EBULIÇÃO: Seus elevados pontos de fusão e ebulição, bem como sua resistência à tração são consequências da grande força da ligação metálica, porque os átomos ficam unidos com muita intensidade. Assim, para desfazer esse tipo de ligação é necessário fornecer muita energia ao sistema. DENSIDADE: A densidade elevada e o fato da maioria dos metais serem sólidos em temperatura e pressões ambientes é consequência das estruturas compactas e cristalinas. MALEABILIDADE E DUCTIBILIDADE: E a maleabilidade e a ductibilidade vêm do fato de que os átomos dos metais podem “escorregar” uns sobre os outros. APLICAÇÕES DAS PRINCIPAIS LIGAS METÁLICAS; - bronze (cobre + estanho) – usado em estátuas, sinos - aço comum (ferro + 0,1 a 0,8% de carbono) – com maior resistência à tração, é usado em construção, pontes, fogões, geladeiras. 3 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 - aço inoxidável (ferro + 0,1 de carbono + 18% de cromo + 8% de níquel) – não enferruja (diferente do ferro e do aço comum), é usado em vagões de metrô, fogões, pias e talheres. - latão (cobre + zinco) – usado em armas e torneiras. - ouro / em jóias (75% de ouro ou prata + 25% de cobre) – usado para fabricação de jóias. Utiliza-se 25% de cobre para o ouro 18K. E o ouro 24K é considerado ouro puro. As substâncias metálicas são representadas graficamente pelo símbolo do elemento: Exemplo: Fe, Cu, Na, Ag, Au, Ca, Hg, Mg, Cs, Li. 4 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 REFERENCIAS BIBLIOGRÁFICAS: FELTRE, Ricardo - Fundamentos da Química (4ª edição), São Paulo - 2005 (Ed. Moderna). ATKINS, P ; JONES L.Princípios de química:questionando a vida moderna e o meio ambiente.1ed.Porto Alegre:Bookman,2001 RUSSEL, John B. Química Geral. 2. ed. São Paulo:Makron Books, 1994. BROWN, Theodore L.et al.Química: a ciência central. 9. ed.São Paulo:Pearson Prentice Hali,2007. SITES UTILIZADOS COMO FONTE: http://www.soq.com.br/ http://www.mundoeducacao.com/ http://www.brasilescola.com/quimica 5
Download