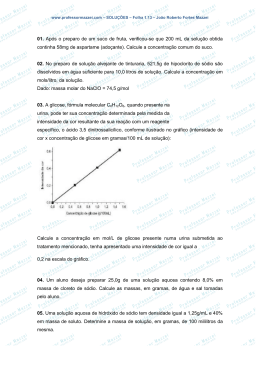
Propriedades das Soluções Ana Carolina R. Teixeira Cínthia M. Santos O Processo de dissolução Soluções saturadas e solubilidade Fatores que afetam a solubilidade Formas de expressar a concentração Propriedades coligativas Colóides Soluções? Uma solução se forma quando uma substância se dispersa uniformemente em outra. Processo de Espontaneidade Entropia Entropia = “desordem do sistema” Espontaneidade Espontaneidade = Formação de Soluções Dissolução X Cristalização Dissolver Soluto + Solvente Solução Cristalizar Solubilidade É a quantidade necessária de soluto para formar uma solução saturada em um certo solvente em uma dada temperatura. “semelhante dissolve semelhante” Soluções Saturadas Insaturadas Supersaturadas Fatores que influenciam na Solubilidade Interação soluto-solvente Quanto maior a atração entre as moléculas do soluto e do solvente, maior será a solubilidade da substância. Exemplo: Existem vitaminas, de acordo com sua estrutura, solúveis em água e gordura. A partir disso, fica mais fácil saber quais devem ser mais ou menos ingeridas pelo nosso organismo. Vitamina A Apolar Vitamina C Polar Pressão Com o aumento da pressão, os choques entre as moléculas se intensificam e assim há uma maior solubilidade. Lei de Henry: S g = k pg Exemplo: Mergulho em águas profundas Os mergulhadores devem emergir lentamente para que, com a diminuição da pressão, os gases dissolvidos não sejam liberados rapidamente do organismo. Temperatura Nos sólidos: Temperatura = Solubilidade Nos gases: Temperatura = Solubilidade Exemplo: Poluição térmica dos lagos e rios Curvas de Solubilidade Propriedades Coligativas Dependem apenas do número de partículas dissolvidas na solução, e não da natureza do soluto. Abaixamento da pressão de vapor Aumento da temperatura de ebulição Abaixamento da temperatura de congelamento Aumento da pressão osmótica Pressão de Vapor Pressão atmosférica A pressão de vapor do álcool é maior do que a pressão de vapor da água. Água Pressão de vapor Álcool Abaixamento da Pressão de Vapor Maior pressão de vapor [ soluto ] = Mais volátil Pressão de Vapor Lei de Raoult Pa = XaPo Aumento da temperatura de ebulição [ soluto ] = 0,5 mol/L 0,5 mol/L T ebulição 1,0 mol/L 1,0 mol/L Abaixamento da temperatura de congelamento [ soluto ] = 0,5 mol/L Temperatura de Congelamento 0,5 mol/L 1,0 mol/L 1,0 mol/L Aditivos nos radiadores de automóveis Sal na neve? Aumento da pressão osmótica [ soluto ] = Pressão Osmótica Colóides São substâncias que não se separam sob a ação da gravidade, mas é possível separá-las usando filtros extremamente finos ou centrifugadoras extremamente potentes. Efeito de Tyndall Os colóides dispersam a luz ao acaso, pois as partículas dispersas têm tamanhos semelhantes ao comprimento de onda da luz visível. Este fenômeno é chamado efeito de Tyndall e permite distinguir as soluções verdadeiras dos colóides, pois as soluções verdadeiras não dispersam a luz. Este efeito também pode ser observado nas manhãs de nevoeiro, onde temos mais um exemplo de um colóide – gotículas de água no ar. Fase Dispersa Gás Gás Meio Contínuo Não existe Líquido Sólido Aerossol Aerossol líquido sólido Líquido Espuma Emulsão Líquida Sol líquido Sólido Espuma Emulsão Sólida sólida Sol sólido Espuma líquida Emulsão líquida Emulsão sólida Sol Líquido Sol Sólido Tratamento de efluentes Precipitação ou floculação para a remoção dos poluentes das águas residuais Indústria de tintas Obtenção de filmes homogêneos e resistentes Produção de impressões com elevado poder de resolução sem entupir os tinteiros Indústria alimentar Mousses, cremes e géis estáveis Cosméticos e produtos de higiene Cremes e pastas-de-dente Indústria dos detergentes Estabilização de solos, líquidos abrasivos Indústria farmacêutica Dispersões estáveis para assegurar uma dose uniforme do princípio ativo Indústria agrícola Dispersão eficaz de pesticidas Referências Bibliográficas Livro : “Química : A Ciência Central”, THEODORE L. BROWN H. EUGENE LEMAY, JR. BRUCE E. BURSTEN www.google.com
Baixar