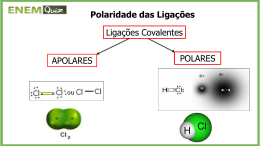
Química Orgânica Aula 2 – Polaridade (eletronegatividade) – Momento Dipolo – Tipos de Interação Prof. Davyson Moreira ([email protected]) 1 Química Orgânica Polaridade da Ligação e Eletronegatividade Os modelos iônicos e covalentes são situações extremas numa condição de ligação química: Na molécula de Cl2 o par de elétrons é igualmente compartilhado e a ligação pode ser considerada como puramente covalente: Ou seja, as estruturas iônicas não contribuem para o híbrido de ressonância; Já numa ligação formada por átomos diferentes, o par de elétrons será desigualmente distribuído O resultado é uma liga ligação covalente polar, uma ligação onde os átomos tem cargas parciais ou residuais Para o H-Cl, a estrutura que mais contribui para o hibrido é aquela com δ+ sobre o H e δ - sobre o Cl Química Orgânica Como explicar a polaridade das ligações? O átomo de cloro tem maior eletronegatividade do que o átomo de hidrogênio, por isso, atrai o par de elétrons da ligação Ainda assim os elétrons da ligação continuam compartilhados pelos átomos que a constituem Química Orgânica Química Orgânica Polaridade da Ligação e Eletronegatividade Quando os átomos possuem grade diferença de eletronegatividade haverá total doação de elétrons de uma átomo para outro e, assim, haverá formação de uma liga ligação Puramente iônica . Química Orgânica Química Orgânica Química Orgânica Eletronegatividade: Química Orgânica Eletronegatividade: Química Orgânica Comprimento de Ligação: Comprimento da ligação é a distância entre os núcleos de 2 átomos ligados ! Depende do tamanho dos átomos! Química Orgânica Comprimento de Ligação: Química Orgânica Comprimento de Ligação: Depende também da ordem de ligação, ou seja, da disposição dos átomos na molécula. Exemplo: para o átomo de oxigênio. 1.430 1.200 1.128 Química Orgânica Comprimento de Ligação: Química Orgânica Polaridade e Momento Dipolo µ: µ do CH4 e CCl4 = 0 por quê? Química Orgânica Tipos de Interação: Relacionados com a polaridade da molécula. Interação íon-dipolo: Interação dipolo-dipolo: Química Orgânica Tipos de Interação: Relacionados com a polaridade da molécula. Interação dipolo induzido ou dipolo instantâneo: Presente em hidrocarbonetos saturados. Interações muito fracas. Também conhecida como força de dispersão de London. Explicam, por exemplo, a diferença de temperatura de ebulição dos seguintes hidrocarbonetos: Química Orgânica Interação dipolo induzido ou dipolo instantâneo: Química Orgânica Ligação Hidrogênio e Solubilidade: Química Orgânica Ligação Hidrogênio e Solubilidade:
Baixar