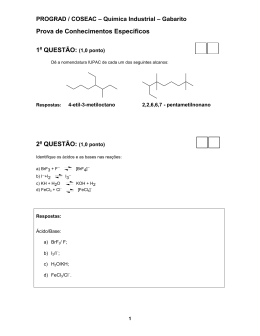
CÁLCULOS ESTEQUIOMÉTICOS são as quantidades de reações químicas necessárias para se obter uma determinada substâncias. PROF. JOÃO BATISTA DE CASTRO QUÍMICA II 1º ANO III ETAPA CÁLCULOS ESTEQUIOMÉTICOS Dicas para resolução 1ª : Acertar os coeficientes, que é o nosso famoso balanceamento. 2ª : Acertar os coeficientes, que é o nosso famoso balanceamento. 3ª : Somar as equações para obtermos uma só. 4ª : Cancelar as substancias "intermediarias", as substancias iguais e que apresentam coeficientes iguais , isso obriga a "multiplicar" ou "dividir" uma outra equação por números convenientes, que levem ao cancelamento desejado. 5ª : Usar cálculo estequiométrico comum, em que a regra de três é estabelecida em função da equação química que resulta da soma das equações intermediárias. PROF. JOÃO BATISTA DE CASTRO CÁLCULOS ESTEQUIOMÉTICOS x Qual a massa de ácido sulfúrico produzido a partir de 8 toneladas de enxofre? 8t Dados: S = 32 e H2SO4 = 98 S + O2 SO2 SO2 + ½O2 SO3 SO3 + H2O H2SO4 32g de S 98g de H2SO4 8 tde S x g de H2SO4 32g x = 98g . 8 de H2SO4 Achar reação global S + ½ O2 + H2O H2SO4 32g 98g x = 24,5tde H2SO4 PROF. JOÃO BATISTA DE CASTRO CÁLCULOS ESTEQUIOMÉTICOS Uma instalação petrolífera produz 12,8kg de SO2 por hora. A liberação desse gás poluente pode ser evitada usando-se calcário, o qual por decomposição fornece cal, que reage com o SO2 formando CaSO3, de acordo com as equações: Ca=40g/mol, S=32g/mol, O=16g/mol, H=1g/mol CaCO3(s) CaO(s) + CO2(g) CaO(s) + SO2(g) CaSO3(s) Qual a massa mínima de calcário (em kg), por dia, necessária para eliminar todo SO2 formado? Suponha 100% de rendimento para as reações. CaCO3(s) + SO2(g) CaSO3(s) + CO2(g) 100g 64g 120g 44g xkg 12,8kg 100g xkg 64g 12,8kg X = 100g.12,8kg/64g X = 20kg por hora X = 480kg em um dia PROF. JOÃO BATISTA DE CASTRO CÁLCULOS ESTEQUIOMÉTICOS (FGV-SP) A floculação é uma das fases do tratamento de águas de abastecimento público e consiste na adição de óxido de cálcio e sulfato de alumínio à água. As reações correspondentes são as que seguem: CaO + H2O Ca(OH)2 3 Ca(OH)2 + Aℓ2(SO4)3 -- 2 Aℓ(OH)3 + 3 CaSO4 Se os reagentes estiverem em proporções estequiométricas, cada 28g de óxido de cálcio originarão de sulfato de cálcio: (dados - massas molares em g/mol: Ca=40, O=16, H=1, Aℓ=27, S=32) a) 204g b) 68g c) 28g d) 56g Se for necessário e) 84g multiplicar ou dividir as equações, Faça. PROF. JOÃO BATISTA DE CASTRO Termoquímica parte I PROF. JOÃO BATISTA DE CASTRO
Baixar