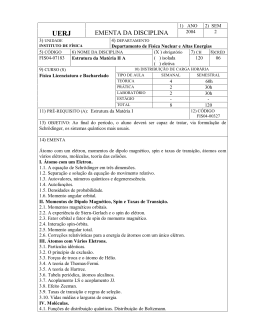
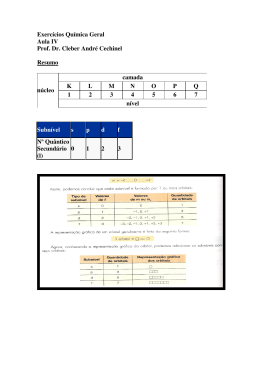
Estrutura Eletrônica – Esquema representativo dos níveis de energia para átomos polieletrônicos Nível Subnível Orbital Diferentes energias entre subníveis de mesmo nível Número quântico principal Número quântico azimutal Número quântico magnético Números quânticos dos elétrons nos átomos Nome Símbolo Valores Especifica Indica Principal n 1, 2, ... nível Tamanho Azimutal l 0, 1, ..., n-1 Subnível, l = s (0), p (1), d (2), f (3) Forma Magnético ml l, l-1, ..., -l Orbitais do subnível Orientação Magnético de spin ms +1/2 e -1/2 Estado do spin Direção do spin Números quânticos dão informações à respeito da probabilidade de localização do elétron. Cada elétron tem um conjunto de números quânticos específicos. Não é possível que dois elétrons tenham os quatro números quânticos iguais. Formas dos orbitais atômicos Orbitais p Orbital s Orbitais f Orbitais d Distribuição dos níveis de energia e configuração eletrônica Átomo de Hidrogênio Átomo de Hélio Átomo de Lítio Átomo de Berílio Distribuição dos níveis de energia e configuração eletrônica Átomo de Boro Átomo de Nitrogênio Átomo de Carbono Átomo de Oxigênio Distribuição dos níveis de energia e configuração eletrônica Átomo de Boro Átomo de Carbono Neônio é um gás nobre – os gases nobres tem distribuição completa dos elétrons nos subníveis disponíveis
Baixar