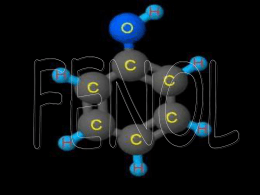
Universidade Estadual de Santa Cruz Programa Regional de Pós-Graduação em Desenvolvimento e Meio Ambiente Mestrado em Desenvolvimento Regional e Meio Ambiente AVALIAÇÃO DA CONCENTRAÇÃO DO FENOL EM RESÍDUOS DE LABORATÓRIOS DE ANÁLISES CLÍNICAS MARIA CLARINDA DE ARAUJO ALMEIDA ILHÉUS – BAHIA 2009 MARIA CLARINDA DE ARAUJO ALMEIDA DETERMINAÇÃO DA CONCENTRAÇÃO DO FENOL EM RESÍDUOS DE LABORATÓRIOS DE ANÁLISES CLÍNICAS Dissertação apresentada ao Programa de Pós-graduação em Desenvolvimento Regional e Meio Ambiente da Universidade Estadual de Santa Cruz, como parte dos requisitos para a obtenção do título de Mestre em Desenvolvimento Regional e Meio Ambiente, Sub-área de concentração: Qualidade Ambiental e Saúde. ORIENTADOR: PROF. DRA. ANDRÉA DE AZEVEDO MORÉGULA CO - ORIENTADOR: PAULO CÉSAR LIMA MARROCOS ILHÉUS – BAHIA 2009 ii MARIA CLARINDA DE ARAUJO ALMEIDA AVALIAÇÃO DA CONCENTRAÇÃO DO FENOL EM RESÍDUOS DE LABORATÓRIOS DE ANÁLISES CLÍNICAS Ilhéus, 20 de julho de 2009. _____________________________________________ Dra. Andréa de Azevedo Morégula (Orientadora - UESC) ______________________________________________ Dra. Adélia Carvalho Melo Pinheiro (UESC) ______________________________________________ Dr. Paulo César Lima Marrocos (UESC) ______________________________________________ Dr. Ricardo David Couto (UFBA) iii A Deus, que nos proporciona a magia que é viver. Aos meus pais, Arlindo (in memorian) e Josefa, pelos exemplos de vida. A Erivaldo, pai dos nossos dois tesouros, Ana Clara e Mariana. Aos meus irmãos e amigos Antero e Tadeu, pelo zelo de pais. iv AGRADECIMENTOS À Professora Doutora Andréa de Azevedo Morégula pela orientação no desenvolvimento deste trabalho e por sua amizade. Ao Professor Doutor Paulo César Lima Marrocos, pela co-orientação, atenção, amizade e generosidade dispensadas a minha pessoa e no desenvolvimento deste trabalho. À Soraya Maria Moreira de Souza, Química Analista Industrial, responsável pelas análises, pessoa que aprendi a gostar e pela amizade constituída. À Professora Doutora Rosilene Aparecida de Oliveira e o Professor Doutor Fernando Faustino de Oliveira, por todo apoio e disponibilidade em ajudar. À Universidade Estadual de Santa Cruz pela oportunidade de realizar esta pesquisa. Ao Professor Doutor Neylor Calazans e Maria Schaun, coordenador e secretária do PRODEMA, por todo apoio ao realizar esta pesquisa. Ao Professor Fermin Velasco chefe do CPqCTR, Centro de Pesquisas Ciências e Tecnologia das Radiações, Núcleo, que me acolheu e que muito me incentivou. Ao Professor Doutor Alex-Allan Furtado de Almeida, chefe do Departamento de Fisiologia Vegetal pela franquia da utilização do Cromatógrafo. Ao chefe do Centro de Pesquisa do Cacau - CEPEC, Dr. Jonas de Souza pela confiança depositada e o apoio para utilização das acomodações e equipamentos. Ao chefe do Setor de Tecnologia e Engenharia Agrícola, SETEA, Raimundo Camelo Mororó e toda sua equipe, pela acolhida e disposição em ajudar. Ao Dr. Miguel Antonio Ruiz, presença marcante num dos momentos mais difíceis da realização dessa dissertação. v Às Amigas, Maria Bernadeth Cruz e Carmênia Guimarães por todo companheirismo, respeito e alegria em partilhar a nossa amizade. À amiga, Ms. Patrícia Costa Oliveira pelo seu incentivo e por ser espelho para minha pessoa juntamente ao seu esposo João Corrêa. Ao Professor Doutor Francisco de Paula, por acreditar em minha possível superação. À amiga, Professora Agnes Fausto e ao Professor Doutor Anderson Mol, por todo carinho e atenção dispensados. À Ms. Candice Messias Barbosa, amiga de todas as horas, obrigada por tudo, sempre. Ao Ms. Marcel Tavares Farias, que muito contribuiu para o desenvolvimento das análises. Ao Ms. Miguel Antonio Quinteiro Ribeiro por suas contribuições. À Mayara Messias, estagiária de Agronomia do SETEA, pelo companheirismo e disposição em ajudar. À Ms. Silmara Hora, amiga a quem aprendi a admirar e que muito contribuiu no desenvolvimento desta pesquisa. A todos os colegas de Pós-graduação que mediante as diversidades de saberes foi possível extrair o melhor de cada um. Saudades. A toda minha equipe de trabalho no laboratório. À minha sócia, Sônia Carvalho. E em especial à Elizabeth e Terezinha, amigas irmãs. À Edna, por cuidar dos meus dois tesouros. À minha família que eu amo tanto e a todos aqueles que de alguma maneira contribuíram. vi AVALIAÇÃO DA CONCENTRAÇÃO DO FENOL EM RESÍDUOS DE LABORATÓRIOS DE ANÁLISES CLÍNICAS RESUMO Durante as últimas décadas, em especial a década de 80, com o advento da AIDS, houve uma maior conscientização a respeito das atividades geradoras de resíduos. Os laboratórios que até então eram considerados como pouco impactantes ao meio, tiveram essa situação de comodidade abalada, devido a mobilização da sociedade civil que vem exigindo mudanças. A ANVISA, implementou a RDC n° 306 de 07/12/2004, criando o PGRSS, Plano de Gerenciamento de Resíduos de Serviços de Saúde e a Prefeitura Municipal de Itabuna, através do Decreto de nº 8.066 de 14/07/08, estabeleceu prazo de sessenta dias para adequação da resolução anteriormente citada, uma vez que o gerenciamento de resíduos sólidos não urbanos, é de responsabilidade do gerador desde sua geração até sua disposição final. A expectativa dessa pesquisa foi avaliar quais as concentrações de fenol, no seu momento de descarte na pia, investigar processos que minimizem os riscos ao ambiente e à saúde pública e validar técnica para extração do fenol. Substância química sólida, tóxica, corrosiva, causadora de agravos aos que o manuseiam dentro ou fora do estabelecimento gerador, constituinte dos reativos utilizados nas análises de colesterol, gerados no setor da bioquímica, de laboratórios de análises clínicas. A Legislação Brasileira permite que um efluente de descarte de qualquer fonte poluidora tenha uma concentração máxima de fenóis de 0,5 µg.ml-¹. Para tanto, utilizou-se a técnica de Cromatografia Gasosa, que no decorrer da pesquisa. Tendo sido capaz de qualificar e quantificar fenol tanto nas amostras do laboratório semi-automatizado quanto automatizado, havendo decréscimo e em seguida, constância nas concentrações de fenol como resultado. Palavras-chave: Resíduos; fenol; meio ambiente; saúde. vii FENOL CONCENTRATION EVALUATION IN CLINICAL ANALYSIS LABORATORIES REMAINDERS ABSTACT During the last decades, specially in the 80th decade, with AIDS advent, there was a bigger awareness about the remainder generator activities.The laboratories that until then were considered as less impacting to the environment, had this comfortableness situation affected, due to the civil society mobilization that has demanded changes. The ANVISA implemented the RDC nº 306 of 12/07/2004, creating the PGRSS, Plan of Health Services Remainder Management, and Itabuna City Hall, through the edict nº 8.066 of 07/14/08, established the time of sixty days for the adjusting previously mentioned, once non urban solid remainders management is of the responsibility of the producer, since its generation until its final disposition. The expectation of this research was to evaluate what fenol concentrations, in its moment of discard in the sink, investigate processes that diminish the environment and public health risks, and validate technique for the fenol extraction. Corrosive toxic solid chemical substance, motivator of damages to those who deal with it inside or outside of the generator establishment, constituting of reactives used in the analyses of cholesterol, produced in the biochemistry sector, of clinical analysis laboratories. Brazilian Legislation permits that a effluent of discarding from any polluting source has a maximum fenol concentration of 0,5 µg.ml-¹. Therefore, it was used the technique of Gaseous Chromatography, in the course of the research. It has been able to qualify and quantify fenol in samples of semi-automated and automated laboratories, with the existence of a diminish and in the sequence, steadiness in the fenol concentrations as a result. Keywords: Remainders; fenol; environment; health. viii LISTA DE FIGURAS 1 Fundamento do métodode dosagem de colesterol.................................... 8 2 Fórmula estrutural do fenol (hidroxi- benzeno).......................................... 17 3 Principais vias de biotransformação do fenol............................................ 20 4 Principais vias de entrada de agentes químicos no organismo................. 20 5 Representação de uma Bacia Hidrográfica............................................... 24 6 Representação esquemática e funcional de um cromatógrafo à gás........ 25 7 Cromatogramas......................................................................................... 26 8 Setores da bioquímica com utilização de equipamento semi-automatizado (A) e automatizado (B)................................................................................... 28 9 Exames realizados no setor da bioquímica do laboratório semiautomatizado............................................................................................. 29 10 Amostras coletadas em um único dia (28.01.09), fracionadas e congeladas de um laboratório manual e automatizado............................. 30 11 Imagem do Setor de Tecnologia e Engenharia Agrícola e do Centro de pesquisas do cacau................................................................................... 32 12 Cromatógrafo VARIAN 3800- SATURNO e Software Varian Star Workstation………………….........….………………………………………… 33 13 Bloco de aquecimento e Banho Seco (Thermolyne Dri Bath), utilizados na extração do fenol.................................................................................. 34 14 Centrífuga com refrigeração e Agitador de tubos (Vortex) e centrífuga, utilizados na extração do fenol.................................................................. 34 15 Soluções mães de fenol e orto-cresol........................................................ 35 16 Representação esquemática do Protocolo para extração de fenol em urina........................................................................................................... 17 Representação esquemática, para extração de fenol em resíduos de laboratórios................................................................................................ 37 38 18 Representação esquemática, para extração de fenol em resíduos de laboratórios................................................................................................ 39 19 Amostras descongeladas........................................................................... 39 ix 20 orto- Cresol adicionado às amostras descongeladas................................ 40 21 Ácido Clorídrico adicionado às amostras e posterior agitação.................. 40 22 Amostras dos resíduos aquecidos em Thermolyne Dri Bath..................... 40 23 Separação da fase orgânica da reação de extração de fenol de resíduos..................................................................................................... 24 Injeção da fase orgânica da extração........................................................ 41 42 25 Cromatograma............................................................................................................. 43 26 Curva de calibração do fenol em metanol, utilizando-se o-Cresol como Padrão Interno (método 1)......................................................................... 45 27 Curva de calibração do fenol em éter, utilizando-se o-Cresol como Padrão Interno realizada 30.04.09 (Método 2).......................................... 46 28 Curva de calibração do fenol em éter, utilizando-se Nitrobenzeno como Padrão Interno realizada 19.05.09 (Método 3).......................................... 46 29 Cromatogramas para otimização das condições cromatográficas............ 47 30 Amostra testemunha.................................................................................. 48 31 Amostra testemunha com adição de fenol e do orto-Cresol...................... 48 32 Gráfico da relação da concentração de fenol em relação ao tempo, das amostras do laboratório semi-automatizado coletada dia 03.11.08 (método 2).................................................................................................. 50 33 Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletada dia 04.11.08 (método 2). 50 34 Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório semi-automatizados coletada dia 03.11.08 (método 3).................................................................................................. 51 35 Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletadas dia 04.11.08 (método 3)................................................................................................................ 36 Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório semi-automatizado coletadas dia 28.01.09 (método 3).................................................................................................. 37 Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletadas dia 28.01.09 (método 3). do laboratório hospitalar coletadas dia 28.01.09 (Método 3)................ x 52 53 53 LISTA DE TABELAS 1 Número de exames de colesterol comparados a totalidade de exames diários.............................................................................................................. 31 2 Relação entre as concentrações do padrão Interno e fenol utilizados para cada método.................................................................................................... 36 3 Áreas de orto-Cresol e fenol e concentração de fenol na amostra testemunha.................................................................................................... 49 4 Porcentagem da recuperação do fenol adicionados à amostra.................... 49 5 Expectativas teóricas das concentrações de descarte de fenol.................... 55 xi LISTA DE QUADROS 1 Tipos de resíduos gerados em estabelecimentos de saúde........................... 2 Sub -classificações dos resíduos químicos que representam risco à saúde pública e ao meio ambiente (Grupo B)............................................................ 6 7 3 Classificação de resíduos de serviços de saúde por categoria, OMS, 1985.. 9 4 Propriedades físico-químicas do fenol............................................................ 18 5 Principais agentes químicos segundo tipo de risco e modo de ação.............. 23 6 Tempo decorrido entre a coleta e o congelamento das amostras colhidas 03 e 04.11.08................................................................................................... 30 Tempo decorrido entre a coleta e o congelamento das amostras de 28.01.09........................................................................................................... 31 7 xii SUMÁRIO Dedicatória............................................................................................................. iv Agradecimentos .................................................................................................... v Resumo................................................................................................................. vii Abstract ................................................................................................................. viii Lista de Figuras.................................................................................................... ix Lista de Tabelas.................................................................................................... xi Lista de Quadros................................................................................................... xii 1. INTRODUÇÃO.................................................................................................. 1 1.1 Objetivos.......................................................................................................... 2 1.2 Objetivo Geral.................................................................................................. 2 1.3 Objetivo Específico.......................................................................................... 2 2. REFERÊNCIAS BIBLIOGRÁFICAS................................................................. 3 2.1 Resíduos sólidos e resíduos sólidos de serviços de saúde (RSS)................. 3 2.1.1 Classificações dos RSS................................................................................ 5 2.2 Impactos ambientais causados pelos resíduos sólidos e sólidos de serviços de saúde................................................................................................................ 2.3 Gerenciamento ambiental................................................................................ 9 12 2.4 Legislação aplicada aos resíduos de serviços de saúde................................ 14 2.5 O fenol............................................................................................................... 17 2.5.1 Aspectos gerais............................................................................................ 17 2.5.2 Toxicidade do fenol....................................................................................... 18 2.5.3 Metabolismo cinético e dinâmico.................................................................. 19 2.5.4 Efeito a saúde humana, ocupacional e animal............................................. 20 2.5.5 Efeito no meio ambiente............................................................................... 21 2.6 Principal técnica para separação de uma mistura: A cromatografia............... 24 3. MATERIAIS E MÉTODOS................................................................................ 28 3.1 Estudo de área................................................................................................ 28 xiii 3.1.1 Coleta e armazenamento das amostras....................................................... 28 3.2 Local onde foram preparadas as amostras..................................................... 32 3.3 Local onde foram realizadas as análises........................................................ 32 3.4 Padronização das condições analíticas.......................................................... 32 3.4.1 Solventes e reagentes.................................................................................. 32 3.4.2 Padrões de referência.................................................................................. 33 3.5 Aparelhos, equipamentos e vidrarias.............................................................. 33 3.5.1 Aparelhos e equipamentos........................................................................... 33 3.5.2 Vidrarias........................................................................................................ 34 3.6 Procedimentos................................................................................................. 35 3.6.1 Limpeza das vidrarias................................................................................... 35 3.6.2 Curva de calibração...................................................................................... 35 3.7 Metodologia para extração do fenol nos resíduos........................................... 36 3.8 Otimização das condições cromatográficas.................................................... 41 3.9 Injeção das amostras no cromatógrafo........................................................... 42 3.10 Validação do método..................................................................................... 43 3.11 Especificidade e seletividade........................................................................ 43 3.11.1 Linearidade................................................................................................. 43 3.11.2 Limite de detecção e quantificação............................................................ 44 3.11.3 Recuperação.............................................................................................. 44 4. RESULTADOS E DISCUSSÃO........................................................................ 45 4.1 Curva de calibração......................................................................................... 45 4.2 Otimização das condições cromatográficas.................................................... 47 5. CONCLUSÃO.................................................................................................... 57 REFERÊNCIAS BIBLIOGRÁFICAS..................................................................... 58 xiv 1 - INTRODUÇÃO Resíduos de Serviço de Saúde (RSS), por serem sólidos ou semi-sólidos resultantes de tais serviços constituem um risco constante à saúde humana e ao meio ambiente e vem se transformando em objeto de debates, estudos e pesquisas a nível mundial. Os laboratórios que eram considerados como pouco impactantes passam a ser chamados a suas devidas responsabilidades, sendo considerados atividades também impactantes. Nos Estados Unidos, a Legislação específica sobre a destinação final dos resíduos, embora seja bastante rígida, classifica as unidades geradoras de resíduos de acordo com a quantidade produzida mensalmente. No Brasil, os RSS chamam a atenção das autoridades públicas relacionadas ao meio ambiente e vigilância sanitária, que publicam Resoluções, estabelecendo padrões e diretrizes para o correto gerenciamento no manejo e disposição final desses resíduos, entendendo a necessidade de proteção à saúde pública e meio ambiente através de uma conduta responsável. De acordo com o Chamamento Público n° 001/2005 da Prefeitura Municipal de Itabuna (PMI, 2005), há 16 laboratórios clínicos habilitados para análises, além de 27 serviços médico-hospitalares que geram um grande número de consultas e exames. Levando-se em consideração o exame de colesterol, sendo a sua demanda de 13100 exames de colesterol/mês para a rede pública de saúde do município e região. Dessa maneira, o presente trabalho visa, diante da demanda de resíduos gerados, em especial, os químicos, em um laboratório clínico e em um laboratório hospitalar da cidade de Itabuna, determinar o teor de Fenol. A metodologia utilizada será a da cromatografia gasosa, objetivando conhecer em que medida esta substância utilizada na composição dos reativos de colesterol, 1 nas mais diversas concentrações, podem vir a causar danos à saúde pública e ao meio ambiente. Informações sobre a problemática serão geradas buscando uma maneira adequada para o descarte dos resíduos, uma vez que na indústria a necessidade de tratamento é justificada a partir de tratamento de efluentes e resíduos, enquanto no caso dos pequenos geradores se faz a terceirização destes serviços (KAUFMAN, 1990) ou mesmo ainda hoje prevalece a cultura do descarte na pia (GERBASE et al., 2005). 1.1 - Objetivos 1.2 - Objetivo Geral Avaliar os teores do fenol lançados por um laboratório semi-automatizado e automatizado em Itabuna, no momento do seu descarte em pia, sem tratamento prévio adequado. 1.3 - Objetivos Específicos Avaliar se os teores do fenol provenientes de laboratórios de análises clínicas no momento do seu descarte nas pias estão dentro dos valores permitidos pela Legislação em vigor; Identificar processos que minimizem os riscos ao ambiente e à saúde pública, seja através da utilização de menores quantidades de reativos ou do tempo de repouso dos resíduos gerados, para posterior descarte; Validar técnica para extração de fenol. 2 2. - REFERENCIAL TEÓRICO 2.1 - Resíduos sólidos e resíduos sólidos de serviço de saúde (RSS) A qualidade de vida do homem e a deterioração ambiental são conseqüências da evolução industrial, que culminou com a elevação da quantidade de resíduos, das mais diversas naturezas, biodegradáveis, não-biodegradáveis, recalcitrantes ou xenobióticos estando diretamente relacionados ao crescimento populacional, características de sexo e faixas etárias, além questões culturais, nível e hábito de consumo, rendas e padrões de vida das populações (BIDONE; POVINELLI, 1999). Além de salientar que o seu volume está associado à produção industrial de bens de consumo e intimamente ligado ao crescimento populacional e, em todos os países, os problemas decorrentes são semelhantes (BIDONE, 2001). A origem antrópica do conceito de resíduo permite defini-lo sob diferentes pontos de vistas: etimológico; econômico; jurídico; sociológico e ambiental. Possuindo como definição francesa, qualquer bem móvel largado ou que seja destinado ao abandono pelo seu dono, originados por substâncias, rejeito de produção, transformação ou de utilização (BIDONE, 2001). Para Barros (2002), a responsabilidade do gerenciamento dos resíduos sólidos urbanos é da Administração Pública Municipal, porém, o gerenciamento de outros tipos de resíduos sólidos é de responsabilidade do seu gerador, conforme Resolução do CONAMA de n°283, do ano de 2001 (BRASIL, 2001). De acordo com Fundação Instituto Brasileiro de Geografia e Estatística (IBGE, 1992) através de dados da Pesquisa Nacional de Saneamento Básico, 228.413 toneladas de resíduos são coletados diariamente no Brasil, sendo que apenas cerca de 1% desses corresponde aos resíduos de serviços de saúde, em um total 3 aproximado de 2.300 toneladas diárias. Sendo que 74% dos municípios brasileiros depositam “lixo hospitalar” a céu aberto, 57% separam os dejetos nos hospitais e apenas 14% das prefeituras tratam adequadamente os resíduos de serviços de saúde. Dessa forma, à proporção que crescem a consciência e a preocupação pública ambiental quanto aos resíduos sólidos produzidos pela sociedade, cresce o interesse para com os RSSS, resíduos sólidos de serviço de saúde (BIDONE, 2001). Segundo Mattoso (1996), os RSS são resíduos sólidos e semi-sólidos resultantes de atividades hospitalares e demais estabelecimentos prestadores de serviços de saúde, sendo fonte de risco à saúde humana e ao meio ambiente devido ao aparecimento de vetores de disseminação de doenças, perigosos tanto para a equipe de trabalhadores dos estabelecimentos de saúde quanto para os pacientes e que possuem potencial de risco, devido presença de materiais biológicos capazes de causar infecção. Como é o caso dos produtos químicos perigosos, objetos pérfurocortantes ou potencialmente contaminados, rejeitos radioativos, frutos de assistência médica, odontológica, laboratorial, farmacêutica, instituições de ensino e pesquisas médicas, relacionados tanto à população humana quanto veterinária e que necessitam de cuidados específicos de acondicionamento, transporte, armazenamento, coleta, tratamento e disposição final (BERTUSSI, 1997). Microorganismos como Mycobacterium tuberculosis, Staphylococcus aureus, Escherichia coli, o vírus da hepatite A e da hepatite B encontram-se presentes nos resíduos de serviços de saúde e apresentam capacidade de persistência ambiental, possibilitando agravos à saúde humana e ambiental associados a diferentes microorganismos patogênicos (SILVA et al., 2002). Sendo muitos os favoráveis ao tratamento diferenciado dos resíduos de serviços de saúde por considerarem que esses resíduos apresentam risco para a saúde do trabalhador, para a saúde pública e para o meio ambiente (GARCIA; RAMOS, 2004). Todavia, outros acreditam que os resíduos de serviços de saúde não tragam risco infeccioso para a o meio e a comunidade à medida que não existem evidências 4 científicas comprovando a existência de lógica causal entre veiculação de doenças e o contato com o resíduo acreditando que a indução de uma doença infecciosa é necessária a presença de um patógeno, de sua virulência, dose de inoculação e da sensibilidade do hospedeiro (ZANON,1991; RUTALA; MAYHALL,1992). De forma consciente, autores ressaltam que a idéia da ausência de riscos dos resíduos de serviços de saúde não deva servir de justificativa para que as instituições de saúde não estabeleçam procedimentos gerenciais que reduzam os riscos associados a tais resíduos (FERREIRA; ANJOS, 2001). E que o gerador de resíduos de serviços de saúde ao cumprir as normas de biossegurança estará prevenindo acidentes aos seres humanos e ao meio ambiente, sendo essa a postura que a sociedade espera dele, não deixando que a idéia da ausência de risco dos RSSS possa induzir a diminuição de custos, as custas de vidas (REBELLO, 2003). Dessa forma a questão dos resíduos sólidos têm sido uma das principais preocupações vividas pelo ser humano. Os resíduos de serviço de saúde, RSS chamam a atenção das autoridades públicas relacionadas ao meio ambiente e vigilância sanitária, que publicam resoluções, estabelecendo padrões e diretrizes para o correto gerenciamento do manejo e disposição final desses resíduos, entendendo a necessidade de proteção à saúde pública e meio ambiente através da conduta responsável, consoante com uma política nacional que concorre com o atual estágio do conhecimento técnico-científico estabelecido e adverte ainda para a função do Estado, através de legislações específicas de normatização cabendo a ele a tomada de medidas para o correto gerenciamento dos resíduos de serviços de saúde (REBELLO, 2003). 2.1.1 - Classificações dos RSS Várias são as classificações encontradas para os RSS. Tanto a ANVISA, quanto a Organização Mundial de Saúde e a Agência Americana de proteção Ambiental, possuem suas próprias classificações para resíduos por categoria. A ANVISA, Agência Nacional de Vigilância Sanitária implementou a RDC n° 302 de 07/12/2004 (BRASIL, 2005), que regulamentou o funcionamento Técnico dos 5 laboratórios e determina a necessidade de se implantar o Plano de Gerenciamento de Resíduos de Serviços de Saúde (PGRSS), atendendo aos requisitos da RDC nº 306 de 07/12/2004 (BRASIL, 2004), onde os mesmos geradores de resíduos sólidos e semi-sólidos, dos tipos: A, B, C, D e E, com potenciais riscos, (biológicos, químicos, radioativos e comuns), possam vir a buscar minimização de agravos (Quadro 1). Quadro 1 - Tipos de resíduos gerados em estabelecimentos de saúde LABORATÓRIO GRUPO A Resíduos com Risco Biológico X GRUPO B Resíduos com Risco Químico X GRUPO C Rejeitos Radioativos GRUPO D Resíduos Comuns X X Microbiologia X X X X Hematologia X X X X Coleta X X X X Patologia Clínica X X X X Bioquímica Fonte: Adaptado (Projeto REFORSUS, 2001). E ainda, a partir da Resolução 33, de 25 de fevereiro de 2003 (ANVISA, 2003), foi inserido o Grupo E, o dos pérfuro-cortantes, objetos e instrumentos contendo cantos, bordas ou protuberâncias rígidas e agudas capazes de cortar ou perfurar (Quadro 2). Assim, os Laboratórios Clínicos, encontram-se diretamente relacionados com a questão, uma vez que, os mesmos, são potenciais geradores dos mais diversos tipos de resíduos anteriormente citados. Por terem sido considerados pequenos geradores, os laboratórios clínicos, durante muito tempo, passaram despercebidos quanto ao seu potencial poluidor. Diferente dos resíduos domiciliares, os RSS podem apresentar grande quantidade de substâncias químicas desinfetantes, antibióticos e outros medicamentos acarretando o risco químico além do biológico (BIDONE, 2001). E por haver a dificuldade de se implantar regras de controle e fiscalização eficientes aos pequenos geradores, infelizmente, ainda hoje, prevalece a cultura do descarte na pia (GERBASE et al., 2005), incluindo substâncias químicas do Grupo B, resíduos com riscos químicos, descartadas muitas vezes de forma aleatória, diretamente na rede 6 de esgotos. Ou através de terceirização como o caso da indústria, onde o tratamento e a disposição dos resíduos acontecem através de uma estação de tratamento de efluentes e resíduos, prática bastante cara (KAUFMAN, 1990). Assim a disposição dos resíduos contendo microrganismos e substâncias químicas podem provocar um aumento das populações bacterianas resistentes a certos antibióticos, detectadas no esgoto de hospitais (KÜMMERER, 2003). Quadro 2 – Sub -classificações dos resíduos químicos que representam risco à saúde pública e ao meio ambiente (Grupo B) CATEGORIA GRUPO B Químicos Resíduo contendo substâncias químicas que apresentam risco à saúde e ao meio ambiente, independente de suas características de inflamabilidade, corrosividade, reatividade, toxicidade. CONSTITUINTE B1 - os resíduos dos medicamentos ou dos insumos farmacêuticos quando vencidos, contaminados, apreendidos para descarte, parcialmente utilizados e demais medicamentos impróprios para consumo, que oferecem risco (hormônio de uso sistêmico e tópico, antibacterianos de uso sistêmico e tópico, citostáticos, antineoplásicos, digitálicos, imunossupressores, imunomoduladores, anti-retrovirais). B2 - os resíduos dos medicamentos ou dos insumos farmacêuticos quando vencidos, contaminados, apreendidos para descarte, parcialmente utilizados e demais medicamentos impróprios para consumo, que, em função do seu princípio ativo e forma farmacêutica, não oferecem risco. Incluem-se neste grupo todos os medicamentos não classificados no Grupo B1 e os antibacterianos e hormônios para uso tópico, quando descartados individualmente pelo usuário domiciliar. B3 - os resíduos e insumos farmacêuticos dos medicamentos controlados pela Portaria MS 344-98 e suas atualizações. B4 - saneantes, desinfetantes e desinfestantes. B5 - substâncias para revelação de filmes usados em Raios-X. B6 – resíduos contendo metais pesados. B7 - reagentes para laboratório, isolados ou em conjunto. B8 – outros resíduos contaminados com substâncias químicas perigosas. Fonte: Resolução nº 33, ANVISA, 2003 (Adaptada). 7 Em especial no setor da bioquímica de qualquer laboratório, os exames de colesterol que utilizam reativos químicos do tipo B7 (Quadro 2), são exemplos relevantes de tal descarte, pela quantidade e freqüência com que os mesmos são realizados corriqueiramente e em sua metabolização (fundamento do método) podermos encontrar concentrações de fenol, substância tóxica, corrosiva e muito deletéria tanto à saúde pública quanto ao meio ambiente, e que, de acordo com a Legislação Brasileira em vigor, segundo o Conselho Nacional do Meio Ambiente, CONAMA (1992), um efluente de descarte de qualquer fonte poluidora deve ter uma concentração máxima de fenóis de 0,5 µg.ml-¹. A Figura 1 nos mostra o fundamento do método para análise do colesterol. Figura 1 - Fundamento do método de dosagem de colesterol. Fonte: Metodologia para o exame de Colesterol – (oxidase- peroxidase) – Biosystens, 2009. O Quadro 3, a seguir nos mostra que os resíduos de serviços de saúde também podem ser classificados por categorias. Dentre elas os dos resíduos químicos estudados encontram-se presentes. 8 Quadro 3 - Classificação de resíduos de serviços de saúde por categoria, OMS, 1985 CATEGORIA Resíduo Comum CONSTITUINTE Resíduos semelhantes aos domésticos, embalagens, camas de animais não infectados, efluentes de lavanderia e outras substâncias que não apresentem problemas de manejo e não ofereçam perigo ao meio ambiente e à saúde pública. Resíduo Patológico Tecidos, órgãos, peças anatômicas, fetos, carcaças de animais, sangue e outros fluídos corpóreos. Resíduo Radioativo Resíduos sólidos, líquidos ou gasosos contaminados por radionuclídeos gerados por análises in vitro de fluidos e tecidos corpóreos, pela localização de tumores no corpo e por procedimentos terapêuticos. Resíduo Químico Resíduos sólidos, líquidos ou gasosos, gerados em processo de pesquisa, diagnóstico, desinfecção e limpeza. Podem ser divididos em perigosos os resíduos tóxicos, corrosivos (ácidos com pH < 2 e bases com pH > 12) inflamáveis, genotóxicos (carcinogênicos, mutagênicos, teratogênicos e outros capazes de modificar o material genético) e reativos (explosivos, hidroativos e sensíveis ao choque). Os resíduos não perigosos são os açúcares, aminoácidos e determinados sais orgânicos e inorgânicos. Resíduo Infeccioso Patógenos em quantidade e concentração tais que a exposição a eles pode resultar em doenças. Esta categoria inclui culturas de microorganismos infecciosos, resíduos de autópsias e de cirurgias de pacientes com doenças infecciosas, resíduos da área de isolamento, da hemodiálise e que entraram em contato com animais contaminados por agentes infecciosos. Resíduo Perfurocortantes Seringas, lâminas, agulhas, escalpes, vidros quebrados, pregos e outros que cortem ou furem a pele. Resíduo Farmacêutico Medicamentos contaminados, vencidos e restos daqueles administrados aos pacientes. Embalagens Pressurizadas Embalagens que contém gases inertes ou aerossóis e que explodem quando incineradas ou perfuradas. Fonte: OMS, (1985) apud SALOMÃO (2003). 2.2 - Impactos ambientais causados pelos resíduos sólidos e semi-sólido de serviço de saúde Modelos tecnológicos e de crescimento que elevam ao máximo os lucros revertendo seus custos em pouco tempo sobre os sistemas naturais e sociais são responsáveis pela detração do ambiente (LEFF, 1993), colocando em risco o futuro da humanidade, uma vez que a manutenção desses padrões ou modelos tornará cada vez mais precária as condições de vida dos seres humanos, chegando ao ponto de inviabilizá-las (GUNTHER et al., 2004). 9 Feld (1971) acredita que os resíduos sólidos podem provocar alterações no solo, água e ar se forem dispostos de maneira inadequada, havendo a possibilidade de causar agravos a todos os tipos de vida, que podem levar anos para aparecer depois de sua disposição final. A destinação inadequada de resíduos sólidos estão relacionadas com a emergência e reemergência de doenças infecciosas (LUNA, 2002). A economia de um país interfere diretamente na geração de resíduos, pois, em períodos de recessão econômica a quantidade de resíduos coletados diminui devido ao aumento da reutilização e decréscimo na geração (POVINELLI, 1999). Muito embora, as externalidades ambientais, devam ser internalizadas à racionalidade dos sistemas produtivos e de mercado como conseqüências indiretas de iniciativas econômicas sobre a natureza (GUNTHER et al., 2004). Câmara e Tambellini (2003) mostram como é difícil a identificação de fontes de emissão de poluentes devido a sua variabilidade e dispersão. “Normalmente, a população é afetada por baixas doses e por tempo prolongado de exposição a diversos poluentes, sendo prejudicada a avaliação da freqüência, magnitude e duração de cada um deles”. E ainda fazem considerações, elucidando que a diversidade do conceito de ambiente amplia o número de saberes exigindo diferentes formas de abordagem metodológica. A Saúde Ambiental, anteriormente relacionada ao saneamento e qualidade da água, incorporou questões como poluição química, pobreza, equidade, condições psicossociais e a necessidade de um desenvolvimento sustentável que possa garantir uma expectativa de vida saudável para as gerações atuais e futuras. A poluição constitui, talvez, a mais devastadora das atividades humanas em relação às populações naturais, exercendo um efeito geralmente deletério sobre grande parte dos organismos que vivem em uma massa d’água, fazendo–se necessária a distinção entre poluição e contaminação. A poluição constitui, talvez, a mais devastadora das atividades humanas em relação às populações naturais, exercendo um efeito geralmente deletério sobre 10 grande parte dos organismos que vivem em uma massa d’água, fazendo-se necessária a distinção entre poluição e contaminação, aspecto de proteção do manancial, os efeitos que dos despejos causa ao manancial e o aspecto da potabilidade da água, ou melhor, dos efeitos que o lançamento pode causar saúde da população abastecida (BRANCO, 1986). Juridicamente, poluição é a adição de qualquer coisa à água que altere suas qualidades naturais de tal modo que o vizinho a jusante não receba, em condições naturais, as águas que lhe são transmitidas (COULSON; FORBES, 1952). Biologicamente, quaisquer tipos de substâncias que alterem a composição ou distribuição das populações aquáticas, através da modificação de quaisquer fatores ecológicos como: composição química e física da água, natureza do leito, correnteza (HAWKES, 1957). De acordo com os dados da EMASA (2008), o sistema de esgotamento sanitário de Itabuna utiliza-se de coleta efetuada em redes de drenagem, redes de esgotos convencionais e redes de esgotos no modelo condominial, com lançamentos diretos no Rio Cachoeira ou em seus afluentes, sendo apenas uma pequena parcela tratada. Segundo o Cadastro de Fontes de Poluição (EMASA, 2008), o Rio Cachoeira dispõe de dez pontos de lançamentos de efluentes, in natura que em sua maioria são descriminados como resíduos domésticos. O nível de atendimento, hoje, é de 64% da população total, sendo que apenas 10% são tratados. Sendo, o Rio Cachoeira o receptor de 90% do esgoto, in natura, coletado na cidade, uma vez que apenas 10% do efluente coletado são tratados na Estação de Tratamento de Esgoto existente. Analisando-se prática acima e para Fonseca (1999), é comum a disposição inadequada de lixo nas coleções hídricas, resultando em quatro tipos de poluição: física; química; biológica e bioquímica. Como conseqüência disso, a Organização Mundial de Saúde (OMS) estima que 25 milhões de pessoas no mundo morre por ano devido a doenças transmitidas pela água como cólera e diarréia. Garcia e Ramos (2004) relatam que no Brasil, o mau gerenciamento dos resíduos acarreta vários agravos que afetam a saúde da população através da 11 contaminação da água, do solo, da atmosfera e da proliferação de vetores provenientes dos resíduos de serviços de saúde. Resíduos geralmente denominados de “lixo hospitalar”, por serem provenientes de hospitais, clínicas médicas e outros grandes geradores e que devido ao gerenciamento inadequado, não existem estatísticas precisas quanto ao número de geradores nem das quantidades geradas diariamente. Quando acontecem emissões de efluentes, ocorrem alterações químicas na composição dos compostos. Observam-se presença de compostos, químico tóxicos, metais pesados com alterações na cor, pH, turbidez, odor, aumento na temperatura provocando desequilíbrio ecológico do corpo receptor, observa-se nutrientes em excesso (eutrofização), além dos sólidos dissolvidos e em suspensão. Os métodos de maior uso para se avaliar impacto ambiental devido a lançamento de efluentes nos corpos receptores são a Demanda Bioquímica de Oxigênio (DBO) e a Demanda Química de Oxigênio (DQO). Métodos de análise simples e de custo baixo, para a quantificação do potencial poluidor dos efluentes. Quanto maior o grau de poluição orgânica, maior a DBO do curso d'água (VON SPERLING, 1996). A multidisciplinaridade comporta uma infinidade de abordagens e articulações inter e transdisciplinares que compreende o ambiente como resultado de processos ecológicos conduzidos pela sociedade, mediante a aplicação das tecnologias e técnicas com as quais os humanos interagem com a natureza. Em saúde ambiental é fundamental a articulação de saberes de diversas áreas do conhecimento, além de não ser possível agir sem a parceria da população (PALÁCIOS et al., 2004). 2.3 - Gerenciamento ambiental O ambiente é definido pela Organização Mundial de Saúde, WHO (1992) como a soma de dados externos que interferem nas condições de saúde e qualidade de vida dos indivíduos ou comunidades. 12 Para Moreira (1999), as abordagens da problemática ambiental em determinado momento apontam a necessidade de paralisação do crescimento populacional ou econômico, ora a correção de danos ambientais, a desocupação humana de alguns ecossistemas, a redistribuição de poder e de recursos produtivos, ora a sustentabilidade ambiental e social, tendo em comum o mesmo conceito de ambiente. Em outras palavras as relações dos homens com a natureza para preservação dos recursos naturais a abordagem majoritária, da Comissão Bruntland (1988; apud MOREIRA, 1999), reconhece o vínculo entre ambiente, ações, ambições e necessidades humanas, tornando o ambiente inseparável do desenvolvimento e em especial do sustentável. Um dos grandes desafios a ser enfrentado é o da conscientização da importância da água para a qualidade de vida da população e como insumo produtivo, através de disseminação de dados, informações, conhecimentos e boas práticas, para a sociedade e seus segmentos, sobre como melhor aproveitar o recurso disponível, conservá-lo em termos quantitativos e qualitativos garantindo os usos múltiplos e visando a sua sustentabilidade (SOARES, 2005; ANA, 2002). Qualquer estratégia adotada para saúde, segurança e impacto ambiental, deve sempre ser considerada tanto por grandes, quanto por pequenos geradores (BINIECKA et al., 2005). Por sua vez, Foster (2005) endossa a idéia, acreditando que a política de redução de resíduos é uma tendência que vem se estendendo também a pequenos geradores como instituições de ensino e laboratórios de pesquisa. Tendo na implantação de gerenciamento, o intuito de garantir higidez e segurança de trabalhadores, população e meio ambiente, devido ao risco do manejo de substâncias químicas (MONTESANO; HALL, 2001; SORENSEN et al.,1998). Segundo Zancanaro Jr (2002, p.133), “O gerenciamento de resíduos é um trabalho que se torna cada vez mais importante, porém, por ser uma atividade relativamente nova no setor de ensino e pesquisa, ainda sofre rejeição e indiferença”. Diante de um mundo globalizado, cada vez mais exigente e alicerçado por Legislação comprometida o controle de processos reduz custos, diminuindo o número de repetições, reduzindo matéria prima e insumos, gerando menos subprodutos, 13 menos resíduos e gastando menos com o manejo e controle da poluição e recuperação ambiental. Além de colocar em prática as diretrizes implementadas, tornando-as realidade, permitindo o controle dos efeitos ambientais de todo o seu processo de produção, desde a escolha da matéria-prima até o destino final (MAZER; CAVALCANTI, 2004). O inventário de passivos e ativos é necessário para que se conheça o caráter e quantidade dos resíduos gerados, ou seja, a dimensão do problema (FOSTER, 2005; JARDIM, 2004). A empresa geradora é a responsável pela separação entre resíduos perigosos e comuns e após a identificação e sua separação, os mesmos devem ser colocados em recipientes adequados, para que a sua coleta, tratamento e destinação final de acordo com suas características (SIQUEIRA, 2001). A necessidade de se ter um ambiente saudável e higiênico como condição básica para predominância de indivíduos sadios, nos conduz a acreditar que “a higiene um dia se tornará guia do administrador assim como do legislador e a economia política, em vez de se devotar exclusivamente à investigação da riqueza nacional, tomará a situação sanitária das populações como ponto de partida de suas doutrinas” (MEYNNE 1944, apud ROSEN 1979:103). 2.4 - Legislação aplicada aos resíduos de serviços de saúde Brasil (1995) define no artigo nº 225 da Constituição Federal promulgada em 1988: “Todos tem o direito ao meio ambiente ecologicamente equilibrado, bem de uso comum do povo e essencial à sadia qualidade de vida, impondo-se ao poder público e à coletividade o dever de defendê-lo e preservar para as presentes e futuras gerações”. A Associação Brasileira de Normas Técnicas, (ABNT, 1987) dispõe de normatizações referentes aos RSS, dentre elas, NBR-10.004, de setembro de 1987 Classificação de Resíduos Sólidos quanto aos riscos ao meio ambiente e à saúde pública. A denominação de Resíduo Sólido, residuu, do latim significa o que sobra de determinadas substâncias. Definidos como aqueles resíduos nos estados sólido e 14 semi-sólido que resultam da atividade da comunidade de origem: industrial, doméstica, hospitalar, comercial, de serviços, de varrição ou agrícola. Incluem-se lodos de ETAS, (Estações de Tratamento de Água) e ETES (Estações de Tratamento de Esgotos), resíduos gerados em equipamentos e instalações de controle de poluição, e líquidos que não possam ser lançados na rede pública de esgotos, em função de suas particularidades, estabelecendo critérios de periculosidade como inflamabilidade, corrosividade, reatividade, toxicidade, patogenicidade. Além de outras normatizações: • NBR 12807 – de janeiro de 1993 - Terminologia dos Resíduos de serviços de saúde, RSS. • NBR 12808 – de janeiro de 1993 - Classificação dos Resíduos de serviços de saúde, RSS. • NBR 12809 – de fevereiro de 1993 - Manuseio de Resíduos de serviços – Procedimentos. • NBR 12810 – de janeiro de 1993 - Coleta de Resíduos de serviços de saúde – Procedimentos. O Regulamento Técnico para funcionamento de laboratórios clínicos, RDC 302 de 13 de abril de 2005; a RDC 306 de 7 de Dezembro de 2004, da ANVISA que foca a saúde pública e prevenção de acidentes, abrangendo todos os serviços relacionados à saúde humana e animal, destacando, porém, os aspectos ambientais. Os resíduos do Grupo B, gerados em quantidades reduzidas permanecem armazenados em seus locais de geração, até o esgotamento do volume do reservatório, sendo depois, descartados na rede de esgoto com diluição, tendo em vista que os produtos químicos que compõe a mistura não são, de acordo com a FISQP, nocivos à saúde pública e ao meio ambiente, na concentração descartada”. (RDC 302 comentada, 2005, p.63). A Resolução CONAMA 20 de 18 de Junho de 1986 (BRASIL, 1986), que foca o Meio Ambiente e controle da poluição aquática, talvez seja uma das principais leis pertinentes ao gerenciamento de resíduos químico-farmacêuticos desde o tratamento até a disposição final. Dispõe sobre a classificação e respectivo nível de qualidade aceitável das águas doces, salobras e salinas. 15 A Resolução CONAMA 238/2001, que dispõe sobre o tratamento e a destinação final dos resíduos dos serviços de saúde, entre outras normas de referência citadas, sendo revogada pela Resolução CONAMA 358/2005 de 29 de Abril de 2005 (BRASIL, 2005), atualizando e complementando a Resolução CONAMA 238/2001, enfatizando a necessidade da minimização da geração de resíduos e redução dos riscos ocupacionais e ambientais. Nos Estados Unidos, a Legislação específica sobre a destinação final dos resíduos, embora seja bastante rígida, classifica as unidades geradoras de resíduos de acordo com a quantidade produzida mensalmente. No Brasil, há uma carência de trabalhos que quantifique e comprove que estes resíduos químicos descartados, possam não estar em conformidade com a legislação. A legislação brasileira permite que um efluente de descarte de qualquer fonte poluidora tenha uma concentração limite máxima de fenóis de 0,5 mg/L (CONAMA,1992).Tal índice ambiental dificulta o encontro de processos de separação químicos e biológicos capazes de atender a essa restrição. Como o fenol é tóxico aos microorganismos e organismos aquáticos, o tratamento biológico se torna mais difícil à medida que a concentração de fenol aumenta, sendo preferível a alternativa da extração por solvente. Contudo Macêdo (2000) acredita que se faz necessário uma fiscalização mais rígida e mais freqüente, apesar da Legislação ser considerada moderna e os consumidores escolherem linhas de produção que não degradem o meio ambiente. No entanto, a Prefeitura Municipal de Itabuna (PMI, 2008) através do Decreto nº 8. 066, de 14 de julho de 2008, artigo 1º, diz que “fica estipulado o prazo de 60 (sessenta) dias, contados da data de publicação do presente decreto, para que os gestores de resíduos oriundos da prestação dos serviços de saúde promovam as devidas adequações ao quanto disposto na Resolução ANVISA nº 306 de 07 de dezembro de 2004 e Resolução CONAMA nº 358, de 29 de abril de 2005, assumindo responsabilidade e custeio integral”. 16 2.5 - O fenol 2.5.1 - Aspectos gerais O fenol é chamado hidroxi-benzeno, apresentando-se no estado sólido, com aspecto cristalino e coloração fracamente rósea ou branca, odor acre e caráter higroscópico em contato com o ar (WHO, 1994; CHEMINFO, 2003). Segundo World Health Organization, WHO (1994) “é uma substância química moderadamente volátil à temperatura ambiente, fracamente ácido, sendo ionizado por reações eletrofílicas e de oxidação”. A Figura 2 mostra a fórmula estrutural do fenol. Figura 2 - Fórmula estrutural do fenol (hidroxi-benzeno). Fonte: Peixe, 2006. Substância bastante utilizada na manufatura de desinfetantes, resinas sintéticas, indústria química e medicinal, estando também presente em águas residuais industriais e de refinaria de petróleo (HUBER; TÁPIA, 1972). No programa denominado IRIS - Integrated Risk Information System (USEPA, 2002), são sugeridas algumas propriedades físico-químicas do fenol, apresentadas a seguir (Quadro 4): 17 Quadro 4 - Propriedades físico-químicas do Fenol Fonte: Peixe, 2006. 2.5.2 - Toxicidade do fenol “A origem da poluição ambiental está indiscutivelmente associada aos ambientes de trabalho, ou mais precisamente aos processos produtivos” (AUGUSTO et al., 2003). Onde ocorre desde a extração das matérias-primas, sua transformação em produtos e seu consumo até o destino final em forma de resíduos. Tendo na variabilidade e dispersão dos mesmos a causa da dificuldade em se identificar fontes emissoras poluentes, geradores de agravos, podendo ser explicada pelo elevado número de substâncias químicas, envolvidas nas diversas atividades econômicas. Para (WHO, 1994; U.S. EPA, 2002; CHEMINFO, 2003), o fenol possui toxicidade moderada nas exposições agudas. Em humanos a dose letal (DL) é 18 estimada em 70 mg/kg, já em ratos e coelhos a DL é de 340 e 850 mg/kg, respectivamente (WHO, 1994; U.S. EPA, 2002; CHEMINFO, 2003). 2.5.3 - Metabolismo cinético e dinâmico A toxicocinética nos informa sobre a maneira como os poluentes penetram no organismo humano, se transformam, são acumulados ou eliminados. “Nesta fase ainda não ocorreram as primeiras reações em âmbito molecular no indivíduo” (CÂMARA; TAMBELLINI, 2003). Por sua vez, é na toxicodinâmica onde acontece o aparecimento de sinais e sintomas que compõem o quadro clínico das intoxicações. “É difícil diagnosticar intoxicações por poluentes químicos porque não existe um quadro clínico clássico para a maioria das substâncias químicas” (CÂMARA; TAMBELLINI, 2003). Ainda segundo Augusto et al. (2003), pesquisas vêm priorizando a identificação de indicadores ambientais, biológicos e clínicos que possibilitem antecipar o desenvolvimento de agravos que possam indicar poluições danosas à saúde; identificar as exposições humanas a situações ambientais potencialmente patogênicas aos seres vivos e particularmente ao homem; e diagnosticar as fases iniciais ainda não aparentes do processo da doença. O fenol é rapidamente absorvido após exposição inalatória, dérmica e oral, sendo distribuído por todos os tecidos. Tendo, os órgãos como fígado, pulmões e mucosa gastrointestinal, envolvidos na biotransformação do mesmo, onde são formados conjugados glicurônicos e sulfatos, bem como, catecol e hidroquinona (WHO, 1994; LEITE, 2003). Podendo sofrer ação na medula por mieloperoxidases liberando quinonas reativas, que seriam, via NQO1, reduzidas novamente a hidroquinona. Tal situação metabólica poderia aumentar o estresse oxidativo e posteriormente alterar o crescimento e diferenciação celular no compartimento medular. A Figura 3 mostra as principais vias de biotransformação do fenol. 19 Figura 3 - Principais vias de biotransformação do fenol. Fonte: Peixe, 2006. 2.5.4 - Efeito à saúde humana, ocupacional e animal São referidos casos de morte após intoxicações dérmica e oral (WHO, 1994). A Figura 4 evidencia as vias de entrada de agentes químicos no organismo e por conseqüência, implicações tóxicas outras associadas como eritema, necrose tecidual, efeitos cardiovasculares, acidose metabólica, efeitos neurológicos e metahemoglobinemia severa (WHO, 1994). Figura 4 - Principais vias de entrada de agentes químicos no organismo. Fonte: Hirata e Mancini Fo, 2002. 20 O fenol, quando inalado, causa irritações nos olhos e no nariz, afeta o sistema respiratório, provoca convulsões e pode levar à morte. Quando em contato com os olhos, causa irritações severas e pode causar cegueira; quando em contato com a pele pode causar irritações severas e queimaduras e quando ingerido pode causar gangrena (morte de tecido ou órgão geralmente por perda de suprimento sanguíneo (pode ser por obstrução de vasos, isquemia, etc.) e ulcerações no sistema digestivo (FAENQUIL, 2006). 2.5.5 - Efeito no meio ambiente Bentur et al. (1998) estimaram a meia-vida biológica (t ½) para o fenol de 13,86 horas. Por sua vez Cheminfo (1994) acredita que a meia vida biológica é de, em média, 12 horas e sua eliminação através da urina, fezes, saliva e suor, sendo a urina a principal via de excreção, podendo ser degradada por fotólise e ter uma meia vida de menos de 1 dia. Quando jogado no solo este material é biodegradável e tem uma meia vida de 1 a 10 dias. Já em contato com a água, tem uma meia vida de 10 a 30 dias, sendo uma substância tóxica para a vida aquática. O fenol desprende um odor doce irritante detectável para a maioria das pessoas em concentrações de 40 ppb no ar e entre 1-8 ppm na água. É menos volátil que a água e moderadamente solúvel na mesma (EPA, 2006). O maior problema causado pela presença de fenol na água é que, ao reagir com o cloro adicionado no tratamento, ele produz compostos chamados clorofenóis, que, mesmo em baixas concentrações, produzem um gosto e cheiro característico na água (gosto “de remédio”). Sendo que as concentrações que podem causar algum efeito à saúde são muito superiores àquelas que alteram o sabor e o odor da água, o que reduz muito os riscos de problemas sanitários ocasionados por essas substâncias (HUBER; TÁPIA, 1972). Nas águas naturais, os padrões para os compostos fenólicos são bastante restritivos. No tratamento da água os fenóis reagem com o cloro livre formando os clorofenóis, dioxinas e furanos, substâncias cancerígenas que produzem sabor e odor na água. Por este motivo, os fenóis constituem-se em padrão de potabilidade, sendo imposto o limite máximo bastante restritivo de 0,001 mg/L pela Portaria 1469 do Ministério da Saúde. 21 O fenol é tóxico para bactérias e fungos e, portanto, componente de fungicidas e desinfetantes. Devido aos seus efeitos anestésicos, é utilizado em remédios, loção para herpes labial, pastilhas e “sprays” para garganta e loções anti-sépticas (EPA U.S., 2006). Em certas concentrações, os fenóis são tóxicos ao homem, aos organismos aquáticos e aos microrganismos que tomam parte dos sistemas de tratamento de esgotos sanitários e de efluentes industriais. Em sistemas de lodos ativados, concentrações de fenóis na faixa de 50 a 200 mg/L, sendo que 40 mg/L já são suficientes para a inibição da nitrificação. Na digestão anaeróbia, 100 a 200 mg/L de fenóis também provocam inibição. Estudos recentes têm demonstrado que, sob processo de aclimatação, concentrações de fenol superiores a 1000 mg/L podem ser admitidas em sistemas de lodos ativados. Em pesquisas em que o reator biológico foi alimentado com cargas decrescentes de esgoto sanitário e com carga constante de efluente sintético em que o único tipo de substrato orgânico era o fenol puro, conseguiu-se ao final a estabilidade do reator alimentado somente com o efluente sintético contendo 1000 mg/L de fenol (CETESB, 2006). Takayanagui (1993) acredita que os resíduos produzidos na área de saúde, representam um risco potencial, e neste caso, trazem grandes danos tanto a saúde do usuário, quanto ao trabalhador que nela atua, bem como ao próprio meio ambiente, Portanto, a população necessita usar corretamente os recursos colocados a sua disposição para que as cidades tenham um estado geral de limpeza satisfatório por maior que seja a influência de serviços (PLASCAK, 1982). O Quadro 5 mostra os riscos e o modo de ação de determinados agentes químicos. 22 Quadro 5 - Principais agentes químicos segundo tipo de risco e o modo de ação Agente Químico Modo de Ação Substâncias que oferecem riscos físicos Asfixiantes Os vapores no ambiente causam sufocação Combustíveis Queimam quando submetidos a temperaturas entre 70 e 93,3°C Corrosivos Queimam quimicamente os tecidos biológicos com os quais tem contato Explosivos Explodem repentinamente sob choque pressão, gás ou calor. Inflamáveis Queimam quando submetidos a temperatura inferior a 70° C Irritantes Substâncias não corrosiva que causam prurido, irritação ou inflamação quando em conto com a pele, olhos ou mucosas Pirofóricos Queimam espontaneamente no ar a temperatura abaixo de 100ºC Peróxidos Orgânicos Explodem espontaneamente em virtude da formação de peróxidos instáveis Oxidantes Promovem ou iniciam a queima de substâncias combustíveis ou inflamáveis Reativos com Água Reagem com a água formando gás tóxico ou inflamável Instáveis ou Reativos Podem explodir mediante pressão, choque ou aquecimento Substância que oferecem risco a saúde Carcinogênicos Causam câncer Mutagênicos Produzem alterações na formação genética hereditária Veneno Causam perigo a vida por danificarem tecidos ou órgãos internos em pequenas quantidades Sensibilizantes São responsáveis por reação alérgica após repetidas exposições com reações adversas severas e risco de morte Teratogênicos Provocam más – formações fetais Tóxicos Causam perigo a vida e a saúde danificando tecidos ou órgão internos entretanto diferente dos venenos por atuarem em quantidade maiores Fonte: Erickson, 1996, adaptada Norma Regulamentadora nº 20 - Líquidos Combustíveis e inflamáveis. Branco (1977) diz que os mananciais hídricos comportam, igualmente, a possibilidade de uso múltiplo, desde que as diferentes atividades, geração de energia, pesca, esportes náuticos, recreação, não implique em prejuízos para a qualidade da água. Likens (1992) nos mostra que vários autores ressaltam a importância do uso do conceito de Bacias Hidrográficas, BH, como análogo ao de ecossistema, definido como unidade espacialmente explícita que inclui todos os componentes bióticos e abióticos e que dentro de suas fronteiras e sua unidade de gerenciamento representa uma estratégia de agregar valor à busca pelo Desenvolvimento Sustentável (Figura 5). 23 Sua consolidação somente acontecerá quando a conservação com desenvolvimento for uma regra para todos, tendo como metas, o desenvolvimento econômico, equidade social, econômica e ambiental, além da sustentabilidade ambiental. Figura 5: Representação de uma Bacia Hidrográfica Fonte: Agência Nacional das Águas /1997. A Organização das Nações Unidas (ONU) crê que a escassez de água no mundo é agravada em virtude da desigualdade social e da falta de manejo e usos sustentáveis dos recursos naturais. Segundo dados da Cetesb (2006), a nação que detiver o controle sobre o uso de tão nobre recurso natural será também detentora de poder e para abastecimento público sendo que a água usada para abastecimento doméstico deve apresentar características sanitárias e toxicológicas adequadas, tais como estar isenta de organismos patogênicos e substâncias tóxicas, para prevenir danos à saúde e ao bem-estar do homem (BRAGA, 1986). 2.6 - Principal técnica para separação de uma mistura: a cromatografia Diversos autores sugerem diferentes metodologias para separação e determinação de substâncias. Entretanto, entre os meios mais modernos, a cromatografia aparece com destaque pela facilidade em efetuar a separação, identificação e quantificação das espécies químicas. 24 A cromatografia é um método físico-químico em que os componentes de determinada mistura se encontram distribuídos em duas fases, sendo uma, estacionária e a outra, móvel. A técnica da cromatografia gasosa (CG) é uma técnica para separação e análise de misturas de substâncias voláteis. Descrita em 1941, pela primeira vez por HESSE et al., que separaram dois ácidos graxos, no vapor a 100º C, arrastando-os sobre sílica com o gás, dióxido de carbono, sendo que a descrição do cromatógrafo gasoso ocorreu através de Cremer e Prior (COLLINS et. al, 1990). A amostra é vaporizada e introduzida em um fluxo de um gás adequado denominado de fase móvel ou gás de arraste. O gás arrasta substâncias presentes na amostra através da coluna e fora dela, sendo os mais utilizados, H 2, Ne, He e Ar devendo ser inerte para impossibilitar interação com a amostra ou fase estacionária e compatível com o detector usado. Com poder de resolução excelente, com ela faz-se possível analisar dezenas de substâncias de uma mesma amostra, além de sua sensibilidade, podendo-se encontrar concentrações baixíssimas que variam de picogramas a miligramas. Este fluxo de gás com a amostra vaporizada passa por um tubo contendo a fase estacionária (coluna cromatográfica), onde ocorre a separação da mistura. A Figura 6 evidencia o esquema de um cromatógrafo a gás. Figura 6 - Representação esquemática e funcional de um cromatógrafo a gás. Fonte: Hackbart, 2007. 25 1- Indica o reservatório de gás e controles de vazão/pressão 2- O injetor (vaporizador) de amostra 3- A coluna cromatográfica e o forno da coluna 4- O detector 5- O amplificador de sinal 6- O registro de sinal (computador). A amostra, através de um sistema de injeção, é introduzida em uma coluna contendo a fase estacionária. A injeção acontece através de válvulas ou microseringas mais comumente utilizadas apesar de terem menor reprodutibilidade devido a possibilidade de acontecer a volatilização do solvente dentro da agulha. O uso de temperaturas convenientes no local de injeção da amostra e na coluna possibilita a vaporização destas substâncias que, de acordo com as suas propriedades e as da fase estacionária, são retidas por tempos determinados e chegam à saída da coluna em tempos diferentes. Com o desenvolvimento do detector por ionização em chama por ampliou-se a sensibilidade do método cromatográfico que quando adequado na saída da coluna torna-se possível a obtenção de resultados quantitativos. Tendo sido a introdução de colunas capilares por Golay 1990, a responsável por tornar o método analítico de separação e determinação mais utilizado no mundo (COLLINS et al., 1990). A Figura 7 a seguir nos mostra o resultado de uma análise cromatográfica, um cromatograma. Figura 7: Cromatogramas. Fonte: Peixe, 2006. 26 Em se tratando do fenol, não foi encontrado na literatura trabalhos referentes a extração do fenol em resíduos. Dessa forma, para realização deste trabalho optou-se em fazer uma adaptação da metodologia utilizada por Peixe (2006) que realizou estudos sobre a concentração de fenol na urina de trabalhadores e no ar de ambiente de trabalho e para uma melhor resolução na determinação de fenol utilizou como condições cromatográficas: coluna HP com 15 m de comprimento, diâmetro de 0,53mm e tamanho de película de 1,5µm. 27 3 - MATERIAIS E MÉTODOS 3.1 - Estudo de área 3.1.1 - Coleta e armazenamento das amostras A coleta das amostras para análises aconteceu a partir de resíduos gerados por um laboratório semi-automatizado e por um laboratório automatizado da cidade de Itabuna. As amostras de ambos os serviços foram coletadas no final do dia de trabalho, contendo a totalidade de todos os reativos utilizados na diária. O primeiro laboratório é um pequeno laboratório, onde os exames são realizados com a utilização de 1,0 mL de reativo por reação e o outro, é um laboratório de hospital, onde os exames são realizados utilizando-se de 0,3 mL de reativo. A Figura 8 mostra ambos os serviços. A) B) Figura 8- Setores da bioquímica com utilização de equipamento semi-automatizado (A) e automatizado (B). Os resíduos químicos analisados foram oriundos do Setor da Bioquímica, setor esse, muito rico no uso das mais diversas substâncias químicas, entre elas o fenol, 28 constituinte do reativo para determinação de colesterol livre e que no mercado pode ser encontrado nas mais diversas concentrações. Em ambos os serviços abordados, o reativo utilizado é da mesma marca, da mesma concentração, utilizado em larga escala, por se tratar de exame corriqueiro. Na Figura 9, podem ser visualizados exames realizados no setor da bioquímica de um laboratório manual e que posteriormente são descartados na rede de esgoto, todos juntos de forma aleatória. Figura 9 - Exames realizados no setor da bioquímica do laboratório semi-automatizado. Em um primeiro momento, foram colhidas duas únicas amostras, sendo uma do laboratório clínico e outra do hospitalar no dia 03 e 04 de novembro de 2008, respectivamente. Da mesma forma , em um segundo momento, foram colhidas duas amostras, também sendo uma do laboratório clínico e outra do hospitalar no dia 28.01.09. A partir delas, foram retiradas alíquotas em dias consecutivos, sendo em seguida congeladas para posteriores análises. Estas aconteceram de início com as coletadas no dia 28.01.09 e posteriormente com as dos dias 03 e 04.11.08 que se encontravam fracionadas e congeladas, já tendo sido feitas análises estando as mesmas com zero hora, 15 horas e 48 horas de congelamento sob o método 1 de condições cromatográficas. As amostras foram mantidas em frascos fechados, em local fresco, seco, ventilado, para observar o tempo necessário para tornar o fenol inerte no universo proposto, uma vez que o período de meia-vida dessa substância é de 30 dias em meio aquoso, podendo assim, vir a ser descartadas de maneira mais segura tanto 29 para a saúde pública quanto para o meio ambiente, sem custos adicionais para as empresas. A Figura 10 retrata as coletas de amostras realizadas no dia 28.01.09 de resíduos realizadas em um único dia, seu fracionamento e congelamento (-20ºC). Figura 10- Amostras coletadas em um único dia (28.01.09), fracionadas e congeladas de um laboratório manual e automatizado. Os Quadros 6 e 7, mostram em que dias em repouso, aconteceram o congelamento das amostras tanto das acima citadas quanto as dos dias 03 e 04.11.08. Quadro 6 – Tempo decorrido entre a coleta e o congelamento das amostras colhidas 03 e 04.11.08 TEMPO DECORRIDO ENTRE A COLETA E O CONGELAMENTO DAS AMOSTRAS ( DIAS) 0 2 22 23 25 30 65 LABORATÓRIO (SEMI-AUTOMATIZADO) LABORATÓRIO (AUTOMATIZADO) 03.11.08 04.11.08 X X X X X X X X X X X X X X 30 Quadro 7-Tempo decorrido entre a coleta e o congelamento das amostras de 28.01.09 TEMPO DECORRIDO ENTRE A COLETA E O CONGELAMENTO DAS AMOSTRAS ( DIAS) LABORATÓRIO (SEMIAUTOMATIZADO) LABORATÓRIO (AUTOMATIZADO) 28.01.09 28.01.09 0 X X 5 X X 9 X X 12 X X 16 X X 22 X X 24 X X 30 X X 32 X X 60 X X A Tabela 1 seguir nos mostra as quantidades de exames de colesterol realizados com relação ao total de exames do dia, em ambos momentos de experimentos. Tabela 1 - Número de exames de colesterol comparados a totalidade de exames diários DATAS LABORATÓRIO CLÍNICO LABORATÓRIO HOSPITALAR 03 e 04 11.08 EXAMES COLESTEROL 36 TOTAL EXAMES 179 EXAMES COLESTEROL 55 TOTAL EXAMES 536 28.01.09 49 181 39 330 A totalidade de exames de colesterol por dia, são bem parecidas em ambos os serviços. Porém, fazendo-se uma comparação com o número de exames realizados diariamente, iremos observar que no laboratório automatizado a quantidade de exames é bem maior, chegando-se a quantidades entre duas ou três vezes maiores que no laboratório semi-automatizado. Levando-se em consideração que a variedade de exames realizados no laboratório automatizado é muito maior que no semiautomatizado, havendo em seus resíduos uma variedade maior de reativos. 31 3.2 - Local onde foram preparadas as amostras Após congeladas, as mesmas foram levadas para o Setor de Tecnologia e Engenharia Agrícola, SETEA, situado no Centro de Pesquisas do Cacau, CEPEC, onde ocorreu a preparação das amostras, através de metodologia para extração do fenol. A seguir a imagem nos mostra o setor acima citado, que dispunha de infraestrutura adequada para realização das extrações de fenol (Figura 11). Figura 11 - Imagem do Setor de Tecnologia e Engenharia Agrícola e do Centro de pesquisas do cacau. 3.3 - Local onde foram realizadas as análises As determinações do fenol aconteceram no Laboratório de Fisiologia Vegetal, da UESC, Universidade de Santa Cruz, Instituição de ensino e pesquisa que dispõe de cromatógrafo gasoso, recurso técnico utilizado para separação e identificação de resíduos. 3.4 - Padronização das condições analíticas 3.4.1 - Solventes e reagentes Para realização da Metodologia proposta foram utilizados: Metanol grau cromatográfico Merck ® (Darmstadt, Alemanha), Ácido Clorídrico P.A. Synth ® (São Paulo, Brasil) e Éter etílico P.A. Synth ® (São Paulo, Brasil). 32 3.4.2 - Padrões de referência Utilizou-se fenol (Padrão de Fenol P. A. 500 g Riedel-de-Haën ® - Seelze, Alemanha) e orto–Cresol 500mg (Fluka) e Nitrobenzeno (Riedel-de-Haën ®) para realização da pesquisa. 3.5 - Aparelhos, equipamentos e vidrarias 3.5.1 - Aparelhos e equipamentos O cromatógrafo utilizado foi o cromatógrafo a gás Varian ® Modelo Saturno 3800, equipado com detector por ionização de chama (FID) e injetor “split/splitless” e Software Varian Star Workstation para aquisição dos dados (Figura 12). A coluna utilizada foi a Varian – Metil Silicone. Figura 12- Cromatógrafo VARIAN 3800 - SATURNO e Software Varian Star Workstation. Utilizou-se os seguintes aparelhos: Balança analítica Sartorius® – modelo R200D; Bloco de aquecimento para tubos e Banho Seco – 150°C Thermolyne Dri Bath (Ver Figura 13); Freezer Brastemp. 33 Figura 13- Bloco de aquecimento e Banho Seco (Thermolyne Dri Bath), utilizados na extração do fenol. Além de pH Checker, Centrífuga com refrigeração e Agitador de tubos (Vortex) e centrífuga (Figura 14). Figura 14 - Centrífuga com refrigeração e Agitador de tubos (Vortex) e centrífuga, utilizados na extração do fenol. 3.5.2 - Vidrarias As vidrarias utilizadas foram: Seringa de vidro Hamilton ® de 5 µL ; Balões volumétricos de 5 e 25 mL; Pipetas automáticas Finpipette-Labsystems (10-100 e 200 -1000 µL); Pipetas de vidro em volumes de 1 e 5 mL; Béqueres; Tubos de vidro com tampa para 15 mL; Tubos de centrífuga; Funis; 34 Vidros coletores para as amostras; Frascos de vidro âmbar de 5 mL; 3.6 - Procedimentos 3.6.1 - Limpeza das vidrarias O procedimento de limpeza das vidrarias aconteceu a partir da lavagem em água corrente com detergente neutro e enxágüe final com água destilada. 3.6.2 - Curvas de calibração Soluções estoque mãe de fenol, Nitrobenzeno e orto - Cresol foram feitas. A solução do fenol teve uma concentração de 1000 µg/mL em metanol. As soluções de Nitrobenzeno e do orto - Cresol tiveram a concentração de 2500 µg/mL, também em metanol (figura 15), evidencia a solução de o-Cresol e fenol. Figura 15 - Soluções mães de fenol e orto-Cresol. As análises aconteceram em momentos distintos e para tanto, soluções padrões foram preparadas com o intuito de se conseguir a curva de calibração inerente a cada experimento. A preparação dos padrões denominada (método1) é concentração de fenol em metanol, com o-Cresol como Padrão interno, preparada para adequação das condições cromatográficas, citadas no item (3.8), onde fez-se a injeção de 2µL no cromatógrafo para posteriores medidas cromatográficas dos padrões e averiguação das áreas detectadas tanto de fenol quanto de o-Cresol para 35 determinação das concentrações dos padrões e assim, caracterização da Curva de calibração. Houve ainda, dois outros momentos de preparação de padrões. Para tanto, realizou-se outras duas curvas de calibração nas mais diversas concentrações, tanto do padrão interno quanto de fenol, citados no item (3.7), como nos mostra a Tabela 9. O (método 2), fenol em éter com o-Cresol como padrão interno e o (método 3), fenol em éter com Nitrobenzeno como padrão interno (Tabela 2). Tabela 2 - Relação entre as concentrações do Padrão Interno e fenol utilizados para cada método Padrão Métodos interno 1 o-Cresol Conc. Padrão interno Padrão Padrão Padrão (µg/ml) 01 02 03 50 5 10 20 Padrão Padrão Padrão Padrão 04 05 06 07 R² 50 100 200 0,996201 2 o-Cresol 500 5 20 50 100 200 - - 0,999443 3 Nitrobenzeno 250 25 50 75 100 150 200 250 0,995153 3.7 - Metodologia para extração do fenol dos resíduos Foi utilizada uma adaptação do trabalho de Peixe (2006) que pesquisou a concentração de fenol na urina de trabalhadores e no ar do ambiente de trabalho.No trabalho citado, foi adicionado 5,0 mL de urina (controle negativo), 50 L do padrão interno – PI, 1,0 mL de ácido clorídrico 37% e aquecimento em estufa a 95° por 1,5 h. Posteriormente, adicionou-se 5,0 mL de éter etílico e 1,0 g de NaCl e agitou-se, em uma mesa agitadora por 10 minutos. Assim, coletou-se 3 mL da fase orgânica e 2,0 µL foram injetados no Cromatógrafo (CG/FID), (PEIXE, 2006). Em resumo, na Figura 16. 36 Figura 16 - Representação esquemática do Protocolo para extração de fenol em urina. Fonte: Peixe, 2006. Nessa pesquisa foram necessárias adaptações da metodologia anteriormente citada (Figura 16). A matriz da amostra utilizada não é a urina e sim, resíduos do setor da bioquímica de laboratório clínico e hospitalar. Dessa forma, várias tentativas de extrações foram efetuadas para que se chegar a uma concentração de volumes e de substâncias adequadas à extração e quantificação do fenol. Tendo sido realizados procedimentos utilizando-se tanto a substância Nitrobenzeno quanto orto-Cresol como padrão interno. Devido às pequenas quantidades de amostras coletadas, propôs-se a adequação da metodologia de Peixe (2006), a seguir, onde pode-se observar: Redução no volume da amostra, redução do volume do padrão interno (alteração de sua concentração), redução do volume de HCl, agitação em vórtex, redução da temperatura e tempo de aquecimento, homogeinização durante 1 minuto após adição do éter etílico e em seguida após a separação da fase orgânica, essa é 37 acondicionada em frasco âmbar, para posterior retirada de 2uL para injeção no cromatógrafo gasoso. A representação esquemática (Figura 17) nos mostra a adaptação utilizada para as amostras coletadas (28.01.09). Figura 17 - Representação esquemática, para extração de fenol em resíduos de laboratórios. Fonte: Adaptado de Peixe, 2006 utilizando as coletas de 28.01.09. Propôs-se outra adequação da metodologia de Peixe, 2006: Com aumento do volume da amostra em relação a adaptação anterior do padrão interno (elevação de sua concentração), redução do volume de HCl, agitação em vortex, redução da temperatura e tempo de aquecimento, homogeinização durante 1 minuto após adição do éter etílico e em seguida após a separação da fase orgânica, essa é acondicionada em frasco âmbar, para posterior retirada de 2uL para injeção no cromatógrafo gasoso. A representação esquemática a seguir (Figura 18), nos mostra a adaptação de metodologia utilizada para as amostras coletadas (03 e 04.11.08). 38 Figura 18 - Representação esquemática, para extração de fenol em resíduos de laboratórios. Fonte: Adaptado de Peixe, 2006 utilizando as coletas de 03 e 04.11.08. A partir da Figura 19, ilustraremos a pesquisa com imagens de amostras colhidas que haviam sido previamente congeladas e posteriormente descongeladas. As determinações aconteceram em triplicata. Figura 19 - Amostras descongeladas. Adicionado a seguir, o volume do padrão interno (orto-Cresol ou Nitrobenzeno), volume relativo de padrão para uma concentração proposta (padrão interno) a cada um dos tubos com o objetivo de avaliar a reprodutibilidade do método. Como nos mostra a Figura 20. 39 Figura 20 - orto- Cresol adicionado às amostras descongeladas. Na Figura 21 abaixo, pôde-se observar o momento em que acrescentou - se ácido clorídrico concentrado, a cada uma delas, com agitação das amostras em agitador de tubos com o objetivo de extrair componentes orgânicos que tenham polaridade semelhante ao éter, voláteis ou não voláteis. Figura 21 - Ácido Clorídrico adicionado às amostras e posterior agitação. Em seguida, aqueceu-se as reações em bloco de aquecimento, no Thermolyne Dri Bath (Figura 22). Figura 22 - Amostras dos resíduos aquecidos em Thermolyne Dri Bath. 40 Após o período de aquecimento, os tubos foram retirados do aquecedor e resfriados em banho de água e a seguir o éter etílico é dispensado em cada tubo. Novamente as amostras foram homogeinizadas e centrifugadas por 1 minuto a 3000 r.p.m. A seguir, separa-se a fase orgânica (superior) e despreza-se a fase aquosa (inferior). A fase orgânica foi acondicionada em tubos com tampas da cor âmbar, cuidadosamente rotulados, ver na Figura 23. Figura 23 - Separação da fase orgânica da reação de extração de fenol de resíduos. As amostras colhidas das pessoas envolvidas com a Bioquímica de ambos serviços pesquisados e das pessoas envolvidas na pesquisa, foram enviadas ao Laboratório H. Pardini para dosagem do fenol. 3.8 - Otimização das condições cromatográficas Para a realização desse experimento, o método utilizado foi a Cromatografia Gasosa, método físico-químico de separação dos componentes de uma mistura, realizada através da distribuição desses componentes entre duas fases. Sendo uma delas estacionária e a outra fase móvel, encontrando – se no estado físico de um gás. Método que ocupa um lugar de destaque devido a sua facilidade em efetuar a separação, identificação e quantificação das espécies químicas. Para tanto foi utilizado um cromatógrafo com detector de ionização de chama (CG/FID), VARIAN3800 SATURNO. 41 Para tanto, foram utilizados: Coluna VARIAN de Metil Silicone - 15 m X 0,53mm X 0,15 micro m. Temperatura do injetor: 200º C Temperatura do detector: 250º C Fluxo de gás de arraste (Hélio): 8,0 mL/ min Temperatura da coluna: Inicial: 60º C / 2min Rate: 10º C / min Final: 120º C / 2 min Modo de injeção: Split ratio 1/10 3.9 - Injeção das amostras no cromatógrafo Foram injetados 2µL das amostras extraídas no CG/ FID, VARIAN SATURNO 3800, como pode ser visto na Figura 24 para posterior observação de cromatograma demonstrados na Figura 25. Figura 24 - Injeção da fase orgânica da extração. 42 Figura 25 – Cromatograma. 3.10 - Validação do método Com o objetivo da validação do método analítico foi utilizada amostra testemunha de resíduo onde supostamente não continha o reativo de colesterol que possui fenol em sua constituição mesmo de outras fontes, como alimentos, que possam ser excretados na forma fenólica (SCALBERT, WILLIAMSON, 2000). Sendo acrescentado fenol e orto-Cresol a essas amostras foram extraídas da mesma maneira que as amostras dos resíduos em estudo (3.7), nas mesmas condições para se concretizar as análises cromatográficas, assegurando qualidade, confiabilidade e aplicabilidade ao método. 3.11 - Especificidade e seletividade As extrações foram efetuadas em triplicatas a partir das amostras colhidas e sendo os seus resultados comparados aos conseguidos com solução do fenol em metanol, numa concentração próxima ao limite de quantificação e detecção. Assim, observando-se a possibilidade de serem encontrados picos interferentes nos tempos de retenção do fenol e do orto-Cresol (padrão interno). 3.11.1 - Linearidade Uma curva de calibração foi construída nas concentrações de fenol previamente conhecidas, com a finalidade de se detectar concentrações crescentes entre 5 e 200 µg/mL de fenol contendo 50 µg/mL do orto-Cresol (padrão interno), descritas anteriormente. A linearidade das curvas foi analisada através das equações 43 da reta e coeficiente de determinação (r²) que deve ser superior a 0,98 (CAUSON, 1997; CHASIN et al.,1999; QUEIROZ et al.,2001; ANVISA, 2003). 3.11.2 - Limite de detecção e quantificação Foi possível verificar através da observação das concentrações do fenol encontradas nos resíduos com o passar dos dias, analisando-se a meia-vida da substância. 3.11.3 - Recuperação É a relação entre a concentração encontrada em uma amostra fortificada e a concentração da mistura de padrões adicionados na amostra testemunha no processo de fortificação, expressa em porcentagem. Utilizada para se determinar a eficiência da extração acontecida durante a metodologia proposta. A eficiência de recuperação deverá ter valores entre 95 A 105%%. Concentração da amostra X 100 RECUPERAÇÃO = Concentração após adição de padrão 44 4 - RESULTADOS E DISCUSSÃO 4.1 - Curva de Calibração Curvas de calibração foram preparadas para cada experimento, a partir de padrões nas mais diversas concentrações. A preparação dos padrões denominada, (método 1) foi processada para adequação das condições cromatográficas, citadas no item (3.8), onde fez-se a injeção de 2µL no cromatógrafo para posteriores medidas cromatográficas dos padrões e averiguação das áreas detectadas tanto de fenol quanto de o -Cresol para determinação das concentrações dos padrões e assim, caracterização da Curva de calibração (Figura 26). Figura 26 - Curva de calibração do fenol em metanol utilizando-se o -Cresol como Padrão Interno (método 1). Houve dois momentos de coletas e fracionamento de amostras. Além da coleta das urinas de pessoas envolvidas nos serviços estudados e das pessoas envolvidas no trabalho. Para tanto, foi necessária a realização de curvas de calibração distintas, devido às análises terem acontecido em momentos diferentes, tendo havido ajustes de metodologia. 45 A injeção dos padrões deu origem às curvas de calibração do fenol utilizadas para realização desse trabalho, cujas concentrações de padrões e o R² encontrados já foram descritos anteriormente no item (3.6.2). As Figuras 27 e 28 nos mostram essas curvas utilizadas para as análises. Figura 27 - Curva de calibração do fenol em éter, utilizando-se o -Cresol como Padrão Interno realizada 30.04.09 ( método 2). Figura 28 - Curva de calibração do fenol em éter, utilizando-se Nitrobenzeno como Padrão Interno realizada 19.05.09 (método 3). 46 4.2 - Otimização das condições cromatográficas Com o objetivo de avaliar se o aparelho estava respondendo bem às condições cromatográficas previamente adotadas pela metodologia proposta e se não sairia nenhuma outra substância no tempo de retenção que não, o fenol, foram injetados no aparelho 2 µL de éter etílico, em seguida 2µL de metanol e 2µL da solução mãe de fenol. Assim, os cromatogramas que se seguem nos dão a certeza de que o aparelho se encontrava em perfeitas condições para análises cromatográficas (Figura 29). Figura 29 - Cromatogramas para otimização das condições cromatográficas. Os cromatogramas foram obtidos através da análise de amostra testemunha, controle negativo, tendo como objetivo de se observar a ausência do fenol e presença do o - Cresol (Padrão Interno), além de picos interferentes nos devidos tempos de retenção. Assim, nos foi possível obter os cromatogramas confirmando a suposição (Figura 30). 47 Figura 30 - Amostra testemunha. Na Figura 31 foi possível evidenciar picos de fenol e o - Cresol, a partir da adição do fenol e do o - Cresol à amostra testemunha. Foram realizadas cinco extrações dessa amostra testemunha, podendo ser vistos abaixo, quatro dos cromatogramas conseguidos. Figura 31 - Amostra testemunha com adição de Fenol e de o –Cresol. A Tabela 3 nos mostra as áreas de fenol, as áreas relativas de orto-Cresol e as concentrações de fenol encontradas na amostra testemunha. 48 Tabela 3 - Áreas de o -Cresol e fenol e concentração de fenol na amostra testemunha CONCENTRAÇÃO AMOSTRA ÁREA ÁREA DO FENOL TESTEMUNHA DO O-CRESOL DO FENOL µg ml-¹ 1 2502234 1398360 86,38 2 2069887 1129487 84,34 3 1903429 1037393 84,24 Os resultados da recuperação de fenol adicionado a uma amostra podem ser observados na Tabela 4. Tabela 4 - Porcentagem de recuperação de fenol adicionados à amostra AMOSTRA CONCENTRAÇÃO DE FENOL NO RESÍDUO (µg ml-¹) RECUPERAÇÃO COM RELAÇÃO AO RESÍDUO (%) RECUPERAÇÃO COM RELAÇÃO AO ÉTER (%) 1 86,38 17,28 31,09 2 84,34 16,86 30,36 3 84,24 16,84 30,32 A Tabela 4 nos mostrou que o índice de recuperação da amostra na extração foi baixo tanto em relação ao volume da amostra de resíduo quanto ao éter utilizado. Lembrando que na reação do exame de colesterol, o fenol em presença da peroxidase tem como produto final a Quinonaimina e água (2.1.1), podendo ser esse um motivo para os resultados encontrados. A partir das amostras colhidas nos dias 03.11.08 e 04.11.08 foram determinadas as concentrações de fenol em triplicatas objetivando melhor evidenciar a reprodutibilidade dos resultados do fenol e da variação de sua concentração no decorrer do tempo. Após 48 horas foi possível observar decréscimo nas concentrações de fenol em ambas as amostras. Nas amostras coletadas no dia 03.11.08 foram detectadas em média 261,0 µg ml-¹ com zero hora em repouso, permanecendo com suas concentrações em 80,3 µg ml-¹ em média após dois dias (48 horas). Concentração essa, 522 vezes maior que o permitido pela Legislação em vigor para descarte que é de 0,5 µg ml-¹ no momento do descarte em pia e 160,6 vezes maior que o permitido, 49 mesmo tendo se passado horas. As Figuras 32 e 33 a seguir nos mostram dados obtidos através de recálculo dos mesmos, necessários uma vez que esses dados foram obtidos pelo (método1), método diferente do utilizado na seqüência de amostras que foram coletadas e congeladas para posteriores análises, sendo possível visualização da caída de concentração. Concentração de Fenol (ug ml -1) 320 280 y = -4,159x + 295,7 R2 = 0,8391 240 200 160 120 80 40 0 0 10 20 30 40 50 60 Tempo (Horas) Figura 32 - Gráfico da relação da concentração de fenol em relação ao tempo, das amostras do laboratório semi-automatizado coletada dia 03.11.08 (método 2). Da mesma maneira foi possível observar decréscimo nas concentrações de fenol nas amostras coletadas no laboratório automatizado no dia 04.11.08. Tendo sido detectada queda nas concentrações de fenol no decorrer dos dois dias (48 horas) partindo as mesmas de uma concentração de 71, 28 µg ml-¹, chegando a zero, esses Concentração de Fenol (ug ml -1) dados foram obtidos por recálculo. 100 80 y = -1,7021x + 90,382 R2 = 0,7424 60 40 20 0 0 10 20 30 40 50 60 Tempo (horas) Figura 33 - Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletada dia 04.11.08 (método 2) 50 Através dos resultados da Tabela 33, foi possível perceber um declínio mais acentuado na concentração de fenol por parte dos resíduos do laboratório hospitalar com o passar das horas comparando-se com os dos resíduos clínicos. Podendo ter uma explicação na variação dos volumes das soluções, sendo as soluções do laboratório automatizado, mais volumosas tanto em quantidade quanto em número de substâncias utilizadas, comparando-se às do laboratório semi-automatizado. A Figura 34 mostra as alíquotas dessa mesma amostra coletadas em 03.11.08 do laboratório semi-automatizado. Cujas extrações e análises aconteceram em outro momento e sob outras condições de análises (método 3). Tais dados permitem averiguar um decréscimo de resultados na concentração da substância analisada uma vez que em zero hora de repouso a concentração encontrada por recálculo foi de 261,0 µg ml-¹, havendo um decréscimo da concentração, porém mesmo com o passar dos dias, sendo que com 30 dias em repouso tal concentração ainda era de 246,11 µg.ml-¹. Através desta figura foi possível observar presença de fenol mesmo com 65 Concentração de Fenol (ug mL -1) dias em repouso numa concentração de 233,57 µg.ml-¹. 270,00 240,00 y = -0,4311x + 261,7 R2 = 0,9534 210,00 0 10 20 30 40 50 60 70 Tempo (Dias) Figura 34 - Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório semi-automatizados coletada dia 03.11.08 (método 3). 51 Diferente aconteceu com as amostras coletadas em 04.11.08 do laboratório automatizado. Observou-se que as concentrações de fenol tenderam a se manter constantes, apesar do ligeiro acréscimo de concentração próximo ao 30° dia, podendo ter sido decorrente da quimiosorção da coluna, onde algum dos componentes orgânicos da mistura se liga a fase estacionária quimicamente. Além da possibilidade de ter sido a própria espessura do filme de coluna utilizada, cerca de 0,15 mm um coadjuvante importante na aquisição de tais respostas. Peixe, 2006 propunha utilização de filme com 1,5mm de espessura. A Figura 35 nos mostra a variação de comportamento das análises com relação às anteriores, uma vez que tais amostras foram analisadas utilizando o mesmo método para curva de calibração (método 3). O Concentração de Fenol (ug mL -1) gráfico explica apenas 36,1% do experimento. 120 80 y = -0,0092x 2 + 1,0066x + 68,349 R2 = 0,3613 40 0 0 10 20 30 40 50 60 70 Tempo (dias) Figura 35 - Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletadas dia 04.11.08 (método 3) Mediante tais resultados encontrados e em busca de melhores esclarecimentos sobre a degradação do fenol com o passar dos dias, as amostras colhidas em 28.01.09 foram analisadas. As Figura 36 e 37 evidenciam as tendências das amostras do laboratório semi-automatizado e automatizado sob o mesmo método de análises. As amostras do clínico tiveram queda em sua concentração em seguida tenderam a estabilizar enquanto que as do laboratório automatizado tiveram suas concentrações estabilizadas após um crescimento de suas concentrações, ambas em patamares de concentração elevados. As do laboratório clínico decrescendo de 79,66 a 70,20, próximo do 30° dia e as do laboratório hospitalar crescendo de 20,70 a 28,20 próximo 52 ao 60° dia em repouso. Dados que nos leva acreditar que realmente houve a quimiosorção da coluna em uso e assim não sendo possível observar a variação de Concentração de Fenol (ug ml -1) concentração do fenol. y = 0,0338x 2 - 1,4951x + 82,787 R2 = 0,7611 90 75 60 45 30 15 0 0 5 10 15 20 25 30 35 Tempo (dias) Figura 36 - Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório semi-automatizado coletadas dia 28.01.09 (método 3). Concentração de Fenol (ug ml -1) 35,0 30,0 25,0 20,0 y = -0,0036x 2 + 0,3531x + 20,199 R2 = 0,8937 15,0 10,0 5,0 0,0 0 10 20 30 40 50 60 70 Figura 37 - Gráfico da relação da concentração de fenol em relação ao tempo das amostras do laboratório automatizado coletadas dia 28.01.09 (método 3). 53 Em ambas as adaptações do Protocolo de Peixe (2006), foi retirado o NaCl. Sua adição, no entanto poderia vir a diminuir a solubilidade de uma substância orgânica na água, aumentando a distribuição do composto orgânico em um determinado solvente orgânico, fenômeno esse chamado de salting-out. A epidemiologia na saúde ambiental impõe desafios aos empreendedores, tendo na interdisciplinaridade, o envolvimento das inúmeras disciplinas do conhecimento nas discussões do monitoramento das situações de riscos e efeitos à saúde relacionados ao ambiente e a multidisciplinaridade, essencial, comportando uma enorme quantidade de abordagens e articulações inter e transdisciplinares que compreendem o ambiente como resultado de processos ecológicos conduzidos pela sociedade, mediante aplicação de metodologias e técnicas com as quais os humanos interagem com a natureza e quando se pensa em uma possível contribuição da mesma deve ser considerada o processo de produção-ambiente-saúde (PALÁCIOS, 2004). Teoricamente, a concentração do reativo de colesterol utilizado em ambos os serviços corresponde à 28 mmoles/L. Cada mol de fenol corresponde à 94g, 1mmol corresponde à 94 mg e 0,028 mmoles, que foi a concentração do reativo de colesterol utilizado corresponde a 2,63 mg/mL. Comparando-se os serviços levando-se em consideração uma média de 20 exames de colesterol por dia (Tabela 5), no caso do laboratório semi-automatizado descartaria 2,63 mg de fenol por exame realizado, pois se utiliza 1,0 mL do reativo para cada reação. Já no automatizado esse descarte seria de 1/3 menos por utilizar cerca de 0,3 mL do reativo por exame. Com relação as amostras, no laboratório semi-automatizado se é utilizado 10 µL enquanto que no hospital apenas 3 µL. A Tabela 5 evidencia as expectativas teóricas das concentrações de descarte de fenol em pia numa rotina de vinte pacientes tanto de um laboratório semi-automatizado quanto automatizado e nos mostra que pode as concentrações tão elevadas como as esperadas mas que estão muitas vezes acima do permitido pela Legislação. 54 Tabela 5 - Expectativas teóricas das concentrações de descarte de fenol LOCAIS DE COLETA QUANTIDADE DE FENOL / 20 EXAMES (mg) DESCARTE (ml) FENOL DESCARTADO (mg/L) QUANTIDADE DE VEZES MAIS QUE CONC.PERMITIDA (0,5 µg ml-¹) 20 EXAMES AUTOMATIZADO 52,60 20,20 2603,96 5207,92 LAB. AUTOMATIZADO 15,93 6,06 2628,71 5257,42 LAB. SEMI- É necessário que as análises aconteçam sem que haja repetições, a partir de um controle de qualidade atuante, onde os profissionais busquem a precisão de seus resultados, através de sua reprodutibilidade e a exatidão dos mesmos sem que para tanto estejam repetindo incessantemente o número de reações, descartando aleatoriamente substâncias poluentes ao meio, agredindo e sendo causa de riscos a saúde pública e ao meio e que de maneira sistemática podem-se reconstruir as situações que envolvem as relações saúde-ambiente a partir de elementos como o poluente, o ambiente, a população exposta. A determinação experimental da concentração das amostras foi obtida a partir do da correlação do sinal (área) de cada componente obtido no equipamento com as das amostras padrão. Assim, sendo obtida uma relação entre a concentração do composto de interesse e a área do padrão. Através da Cromatografia Gasosa, utilizando-se a metodologia de (Peixe, 2006), foi possível no decorrer da pesquisa qualificar o fenol tanto nas amostras do laboratório clínico quanto nas do laboratório hospitalar, porém não foi possível quantificá-lo. Por isso foram propostos os ajustes que se seguiram ao protocolo, devido a necessidade buscar a quantificação exata do fenol nas mesmas, acreditando-se que o não sucesso teria sido por conta da não extração do padrão interno utilizado, o Nitrobenzeno. Na realidade, a metodologia proposta era para urina e não para uma mistura aquosa de resíduos composta das mais diversas qualidades de reativos em concentrações diversas. Por ser o fenol tóxico aos microorganismos e organismos aquáticos, o tratamento biológico se torna mais difícil à medida que a concentração de fenol aumenta, sendo preferível a alternativa da extração por solvente, o éter di-isso55 propílico é citado como possível solvente capaz de extrair fenol de água, mas que não apresentam em literatura dados experimentais de equilíbrio líquido-líquido para o sistema formados com fenol e água. 56 5. CONCLUSÃO Os teores de fenol das amostras de ambos os serviços, no momento de descarte em pia estavam acima do permitido pela Legislação em vigor. Foi possível observar a queda da concentração de fenol com o passar de horas (dois dias). No entanto, sua meia-vida não foi possível ser identificada. Devido aos resultados das amostras seguintes tenderem a uma constância de concentrações. A metodologia de (Peixe, 2006), não nos permite validar essa técnica para extração de fenol em resíduos, pela complexidade das amostras sanguíneas e condições dos estudos nesta área. Assim sendo, faz-se necessário um cuidado especial com o descarte dos resíduos provenientes do setor da bioquímica de laboratórios de análises clínicas. Por ser um setor rico na utilização de substâncias químicas, muitas vezes não totalmente decompostas e que vir a ser causa de agravos à saúde e ao meio ambiente. 57 REFERÊNCIAS BIBLIOGRÁFICAS ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 10.004 Resíduos Sólidos: Classificação. Rio de Janeiro, 1987. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 12.807 – Terminologia dos Resíduos de serviços de saúde, RSS. Rio de janeiro, 1993. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 12.808 Classificação dos Resíduos de serviços de saúde, RSS. Rio de Janeiro, 1993. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 12.809 Manuseio de Resíduos de serviços: classificação. Rio de Janeiro, 1993. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 12.810 - Coleta de Resíduos de serviços de saúde. Rio de Janeiro, 1993. ANA - Agência Nacional das Águas. A Evolução da Gestão dos Recursos Hídricos no Brasil. Ed. Comemorativa do Dia Mundial da Água, Brasília, DF, 2002. Disponível em: www.ana.gov.br. Acesso em: 24 de Julho de 2008. 1997. ANVISA – Agência Nacional de Vigilância Sanitária. Regulamento Técnico para gerenciamento de resíduos de saúde. Resolução RDC nº 33 de 25 de fevereiro de 2003. AUGUSTO, L.S.; CÂMARA, V.M.; CARNEIRO, F.F.; CÂNCIO, J.; GOUVEIA, N. Saúde e ambiente: uma reflexão da Associação Brasileira de Pós-Graduação em Saúde Coletiva – ABRASCO. Revista Brasileira de Epidemiologia, vol. 6 (2), 2003. BARBOSA, H. Controle Clínico do Paciente Cirúrgico. Livraria Atheneu Ltda, Rio de Janeiro, 1976. BARROS, C. J. Os resíduos sólidos urbanos na cidade de Maringá - Um modelo de gestão. Departamento de Engenharia Química/ UEM. Maringá, 2002. BENTUR, Y.; SHOSHANI, A.O.;TABAK, E. Prolonged elimination half-life of phenol after dermal exposure. Journal of Toxicology – Clinical Toxicology. 36 (7): 707-711, 1988. BERTUSSI FILHO, L. A. Lixo hospitalar: higiene ou matemática. Saúde em Debate. Vol 26, 60 - 64, 1997. 58 BIDONE, F.R.A. Resíduos Sólidos provenientes de coletas especiais: eliminação e valorização. Associação Brasileira de Engenharia Sanitária e Ambiental, 2001. BIDONE, F.R. A.; POVINELLI, J. Conceitos Básicos de Resíduos Sólidos. 1ª Ed. EESC- USP, 109p, 1999. BINIECKA, M; CAMPANA, P.; IANNILLI, I. The technological and economic management of the environmental variable in the pharmaceutical - chemical industry. Microchemical Journal. 79., 325 - 329, 2005 BRAGA, J. C. S.; PAULA, S. G. Saúde e previdência: estudos de política social. 2ª Ed. São Paulo, 18-135, 1986. BRANCO, S. M. Hidrologia Aplicada à Engenharia Sanitária. 3ª Ed. São Paulo, 1986. BRANCO, S. M.; ROCHA, A. A. Poluição, proteção e usos múltiplos de represas. CETESB - São Paulo, 1977. BRASIL, Constituição da República Federativa do Brasil. Promulgada em 5 de outubro de 1988. Saraiva, São Paulo, 1995. BRASIL, Ministério da Saúde. ANVISA - Agência Nacional de Vigilância Sanitária. Resolução da ANVISA nº 306, de 07 de Dezembro de 2004. Diário Oficial de União, Brasília, 10 de Dezembro de 2004. BRASIL. Ministério da Saúde. ANVISA - Agência Nacional de Vigilância Sanitária. Resolução da ANVISA nº 302, de 13 de Abril de 2005. Diário Oficial de União, Brasília, 15 de Abril de 2005. BRASIL, Ministério do Meio Ambiente. Resolução do CONAMA nº 5, de 5 de Agosto de 1993. Definição de resíduo sólido, plano de gerenciamento de resíduo sólido, sistema de tratamento de resíduos sólidos, sistema de destinação final de resíduos sólidos (DOU 31.08.93). BRASIL, Ministério do Meio Ambiente. Resolução do CONAMA nº 283, de 12 de Julho de 2001. Disposição sobre o tratamento e disposição final de resíduos de serviço de saúde. BRASIL, Ministério do Meio Ambiente. Resolução do CONAMA nº 20, de 20 de Junho de 1986. Classificação das águas doces, salobras e salinas no território nacional. Disponível em: <http://www.mma.gov.br/ port/ conama/ res86/ re2086.html>. Acesso em: 05 nov. 2007. BRASIL, Ministério do Meio Ambiente. Resolução do CONAMA nº 358, de 29 de Abril de 2005. Dispõe sobre tratamento e disposição final dos resíduos de serviços 59 de saúde e dá outras providências. Diário Oficial de União, Brasília, 4 de Maio de 2005. CÂMARA, V. M.; TAMBELLINI, A.T. Considerações sobre o uso da epidemiologia nos estudos em saúde ambiental. Revista Brasileira Epidemiologia. 6 (2), 2003. CAUSON, R. Validation of chromatographic methods in biomedical analyses – Viewpointand discussion. Journal of Chromatography B., 689, 175-180, 1997. CETESB - Gerenciamento de Resíduos Químicos Provenientes de Estabelecimentos de Serviços de Saúde (Procedimento). Disponível em: < http: www.cetesb.sp.gov.br>. Acesso em: 21 de janeiro de 08. CETESB - Variáveis de qualidade das águas. Disponível em: <http://www. cetesb.sp.gov.br /Agua/rios/variaveis.asp#fenois>. Acesso em: 05 de Junho de 2007. CHASIN, A. A. M.; NASCIMENTO, E. S.; NETO, L. M. R.; SIQUEIRA, M. E. P. B.; ANDRAUS, M. H.; ALVADORI, M. C.; FERNÍCOLA, N. A. G.; GORNI, R.; SALCEDO, S. Validação de métodos em análises toxicológicas: uma abordagem geral. Revista Brasileira de Toxicologia. 11 (1), 1-6, 1999. CHEMINFO - CHEMISTRY INFORMATION. Phenol. Canadian Centre for Occupational Health and Safety. 19 p, 2003. COLLINS, C.H.; BRAGA,G.L.; BONATO,P.S. Introdução a métodos cromatográficos. 4. ed. Campinas: Unicamp,1990 (Série Manuais) CONSELHO NACIONAL DO MEIO AMBIENTE (Brasil). Resoluções CONAMA 19841991. 4ª ed. Brasília, DF.1992. CONSIGLIERI, V.O. “Riscos ocupacionais devido aos agentes químicos”. Manual de segurança em laboratório. São Paulo: Faculdade de Ciências Farmacêuticas USP, 23-27, 2001. COULSON & FORBES – The Law of Waters and Land Drainage. 6ª Ed, Sweet &Maxwell Ltd., E.U.A., 1952. EMASA – Empresa Municipal de Água e Saneamento, Cadastro de Fontes de poluição. SAA DE ITABUNA - Zonas de abastecimento, 2008. EPA - U.S. Environmental Protection Agency. Toxicological review of phenol < http://www.epa.gov/IRIS/toxreviews/0088-tr.pdf >. Acesso em 20 de março de 2006. EPA - U.S. Environmental Protection Agency. Toxicological review of phenol. Disponível em:< http://www.epa.gov/IRIS/toxreviews/0088-tr.pdf >. Acesso em 20 de março de 2008. 60 EPA - U.S. Environmental Protection Agency. Toxicological review of phenol < http://www.epa.gov/IRIS/toxreviews/0088-tr.pdf >. Acesso em 12 de maio de 2007. FAENQUIL. Mini-folhetos de Informações de segurança (mini-fis) < http://www. faenquil.br/gsmt-cipa/3normalizacao/mini_fis/mini_pdf/fenol076.pdf >. Acesso em16 de maio de 2007. FELD, J. Production and Disponal of wastes Social consequences – Poliay Implications. Anmalsof the New York Academy of Sciences. Vol 184, 1971. FERREIRA, J. A ; ANJOS L.A. Aspectos de Saúde coletiva e ocupacional associados à gestão dos resíduos sólidos municipais. Cad. Saúde Pública. 17, 689 -96, 2001. FONSECA, E. Iniciação ao estudo dos resíduos sólidos e da limpeza urbana. Editora União. 1999. FOSTER, B.L. The chemical inventory management system in academia. Chemical Health Safety, 12 (5), p.21-25, 2005. GARCIA, L. P; RAMOS, B.G.Z. Gerenciamento dos resíduos de serviços de Saúde: uma questão de biossegurança. Cad. Saúde Pública, Rio de Janeiro, 20 (3): 744-752, 2004. GERBASE, A. E.; COELHO, F. S.; MACHADO, P. F. L.; FERREIRA, V. F. Gerenciamento de resíduos químicos em instituições de ensino e pesquisa. Química Nova. 28, p.3, 2005. GUNTHER, H. et al. Psicologia Ambiental: Entendendo as relações do homem com o seu ambiente. Campinas: Alínea, 2004. HACKBART, L. M. Equilíbrio líquido-líquido de sistemas contendo fenol-águasolvente: obtenção e modelagem termodinâmica. Dissertação (Mestrado). Universidade Federal do Paraná, 2007. HAWKES, H. A. – Biological Aspects of river pollution. In Aspects of River Pollution, by L. Klein: 191-215. Butterworths Scientific Publications, Inglaterra , 1957. HIRATA, M. H.; FILHO MANCINI, J. Manual de Biossegurança. São Paulo: Manole, 2002. HUBER, W; TÁPIA, M. Água para consumo humano e os controles exigidos. FEI – Faculdade de Engenharia Industrial – 1972. IBGE. INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Pesquisa Nacional de Saneamento Básico - 1989. Fundação Brasileira de Geografia e Estatística, 1992. 61 IMBROISI, D.; GUARITÁ-SANTOS, A. J. M.; BARBOSA, S. S.; SHINTAKU, S. F.; MONTEIRO, H. J.; PONCE, G. E.; FURTADO, J. G.; TINOCO, C. J.; MELLO, D. C.;MACHADO, P. F. L. Gestão de resíduos químicos em universidades: Universidade de Brasília em foco. Química Nova. 29 (2), 404-409, 2006. JARDIM, W. F. Gerenciamento de Resíduos Químicos em Laboratório de Ensino e Pesquisa. Biossegurança Aplicada a Laboratórios e Serviços de Saúde - Mastroeni, M.F. ATHENEU, 2004. KAUFMAN J. A. Waste Disposal in Academic Institutions. Nova Iorque: Editora Lewis, 1990. KÜMMERER K. Significance of antibiotics in the environment. Journal of Antimicrobial Chemotherapy. 52, 5-7, 2003. LEFF, E. Saber Ambiental. Ed. BRASILIOENSE, 1993. LIKENS, G. An Ecosystem Approach: its Use and abuse. Excellence in Ecology, Book 3. Ecology Institute, 1992. LUNA, E. J. A. A emergência das doenças emergentes e as doenças infecciosas emergentes e reemergentes no Brasil. Revista Brasileira de Epidemiologia, 5, 229-243, 2002. MACÊDO, J.A.B. As Indústrias Farmacêuticas e o Sistema de Gestão Ambiental (SGA). Revista Fármacos & Medicamentos. Editorial Racine. Maio/junho, 46-50, 2000. MATTOSO, V. D. B. Classificação, quantificação e análise microbiológica dos resíduos de serviço de saúde da Santa Casa de Misericórdia de São Carlos. São Carlos. 90p. Dissertação (Mestrado) – Escola de Engenharia de São Carlos, Universidade de São Paulo, 1996. MAZZER, C.; CAVALCANTI, O. A. Introdução à gestão ambiental de resíduos. PHARMÁCIA BRASILEIRA. Nov / Dez, 67-77, 2004. MINISTÉRIO DA SAÚDE: Secretaria de Assistência à Saúde. Sistema de Avaliação do Projeto REFORSUS: Metodologia de Avaliação dos Subprojetos do Componente. Brasília, 60p, 1999. MONTESANO, R.; HALL, J. Environmental causes of human cancers. European Journal of Cancer. 37, 567-587, 2001. MOREIRA, A. C. M. L. Conceito de Ambiente e Impacto Ambiental Aplicáveis ao Meio Urbano. Material didático da disciplina de pós-graduação AUP 5861- Políticas Públicas de proteção do ambiente urbano. São Paulo, 1999. 62 PALÁCIOS, M; CÂMARA, V. M; JESUS, I. M. Considerações sobre a epidemiologia no campo de práticas de saúde ambiental. Epidemiologia e Serviços de Saúde. 13 (2): 103 –113, 2004. PEIXE, T. S. Validação e aplicação de métodos para análise de amostra de fenol em urina de trabalhadores e no ar do ambiente de trabalho. Dissertação (MESTRADO). Faculdade de Ciências farmacêuticas. Universidade de São Paulo, 2006. PLASCAK, G.M. De S. Campanhas educativas. Curso Básico para Gerenciamento de Resíduos. São Paulo: CETESB, 1982. PMI - Prefeitura Municipal de Itabuna, Chamamento público n° 001/2005. Dispõe sobre convocação de prestadores se serviços em saúde. PMI - Prefeitura Municipal de Itabuna, Decreto nº 8. 066, de 14 de julho de 2008. Estabelece prazo para que os geradores de resíduos oriundos de serviços de saúde se adequem. PROJETO REFORSUS – Ministério da Saúde, Gerenciamento de resíduos de serviços de saúde. Brasília, 2001. QUEIROZ, S. C. N.; COLLINS, C. H.; JARDIM, I. S.F. Métodos de extração e/ou concentração de compostos encontrados em eluídos biológicos para posterior determinação cromatográfica. Química Nova. 1, 68 - 76, 2001. RDC 302. Regulamento Técnico para funcionamento de Laboratórios Clínicos. Comentada pelos assessores científicos do PNCQ. V 3.0. REBELLO, P. R. Resíduos sólidos em serviços de saúde. In: VALLE, S.; TELES, J. L., ORGANIZADORES, Bioética e biorrisco: abordagem transdisciplinar. Rio de Janeiro: Editora Interciência; p.391-412, 2003. ROSEN, George. Da polícia médica à medicina social. Rio de Janeiro: Graal, 1979. RUTALA, W. A; MAYHALL, C. G; Medical Waste : SHEA Position paper. Infection Control and Hospital Epidemiology. 13: 38-48, 1992. SALOMÃO,I.S. Gerenciamento interno de resíduos sólidos de centros cirúrgicos. Ilhéus, Ba: UESC/PRODEMA, 2003. SCALBERT, A.; WILLIANSOM, G.; Dietary intake and biovailability of polyphenols. J. Nutr., Rockville,v.130, n.8, suppll., 2000 S 2073- S 2085. SILVA, A. C. N; BERNARDES, R. S; MORAES,L. R. S; REIS, J. D. P. Critérios adotados para seleção de indicadores de contaminação ambiental relacionados aos resíduos dos serviços de saúde: uma proposta de avaliação. Caderno de Saúde Pública, 18: 1401-9, 2002. 63 SIQUEIRA, A. Resíduos Sólidos: Da Classificação à Disposição Final. Revista Fármacos e Medicamentos. Editorial Racine. Jan /Fev, 10-16, 2001. SOARES,A. A. Os Comitê de Bacia Hidrográfica com Órgãos de Administração de Recursos Hídricos e Proteção Ambiental II Congresso Internacional de Direito Amazônico. Belém PA, Maio 2005. Disponível em: www.aldoasevedo.adv.br/artigos/amazonico.htm. Acesso em: 11 de Junho de 2008. TAKAYANAGUI, A. M. M. Trabalhadores de saúde e meio ambiente: ação educativa do enfermeiro na conscientização para gerenciamento de resíduos sólidos. Ribeirão Preto. 179p. Tese (Doutorado) – Escola de Enfermagem, Universidade de São Paulo,1993-A. TAKAYANAGUI, A. M. M. Consciência ecológica e os resíduos de serviços de saúde. Revista Latino-americana de Enfermagem-Ribeirão Preto. 1 (2), 93-96, 1993-B. U.S. EPA UNITED STATES- ENVIRONMENTAL PROTECTION AGENCY. Toxicological review of phenol. Integrated Risk information system (IRIS) Washington: U.S. EPA, 213 p, 2002. USEPA. A Conceptual Framework to Support Development and Use of Environmental Information in Decision- making. 230- R 95-012,1995. WORLD HEALTH ORGANIZATION (WHO). Our Planet, Our Health: report the WHO commission on health and Environment. Genebra: WHO, 1992. WORLD HEALTH ORGANIZATION (WHO). Phenol. International Programme on Chemical Safety. Geneva: WHO, p. 98, 1994. VARIAN 50 ANOS. Introdução à Cromatografia Gasosa. 1990. VON SPERLING, M. Princípios do tratamento biológico de águas residuais – Introdução à qualidade das águas e ao tratamento de esgoto. Vol.1, 2ª ed. DESA-UFMG. Belo Horizonte – MG, 1996. ZANCANARO J. O. Manuseio de Produtos Químicos e Descarte de seus Resíduos. In: HIRATA, M.H.; FILHO MANCINI, J. Manual de Biossegurança. São Paulo: Manole, 2002. ZANON, U. Riscos infecciosos imputados ao lixo hospitalar: realidade epidemiológica ou ficção sanitária? Revista da Sociedade Brasileira de Medicina Tropical, 1991. 64
Download