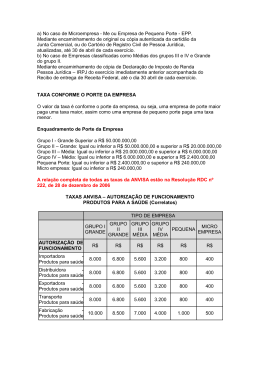
Pela primeira vez um evento idealizado e realizado para todos os tipos de profissionais que atuam no mercado de produtos para saúde (“correlatos”). Com uma linguagem simples e abordagem direta cada um dos cursos propostos pretende apresentar questões atuais, práticas e que, por inúmeras vezes, são fonte de grande preocupação e transtornos, principalmente relacionados à estratégia organizacional e ao resultado dos negócios das empresas do ramo. Questões relacionadas com: Como começar uma empresa de produtos médicos, primeiros passos e cuidados para o sucesso do negócio; Distribuidora x Importadora x Fabricante? Qual o melhor? Qual o verdadeiro papel do Responsável Técnico na Gestão de um sistema Boas Práticas; A importância do gerenciamento de projetos para o sucesso do sistema de Boas Práticas de Fabricação; As atuais regulamentações da ANVISA e os impactos diretos na operacionalização e no resultado dos negócios; Boas Práticas e aspectos legais correlacionados; Elaboração e implementação da Tecnovigilância e seu papel para sobrevida do produto no mercado; A quem se destina: Profissionais de assuntos regulatórios, empresários (comércio, distribuidores, importadores, fabricantes, etc.), profissionais de vigilância sanitária, profissionais da área da qualidade, alunos ou profissionais com interesse em adquirir conhecimentos específicos e práticos na área de regulação de produtos para saúde (“correlatos”). Palestrantes: Luiz A. M. Valente Formado em Farmácia-Bioquímica com habilitação em Análises Clínicas pela Universidade Estadual de Londrina (1987); Bacharel em Direito pela Instituição Toledo de Ensino – Bauru (1996); ordenado Advogado (1997) e Especialista em Saúde Coletiva / Vigilância Sanitária pela Universidade de Brasília (2002). Experiência profissional em atividades de Vigilância Sanitária de mais de 15 anos. Exerceu suas atividades de maio/2002 a junho/2006 na Unidade de Inspeção e Certificação de Produtos para Saúde (“Correlatos”) da Agência Nacional de Vigilância Sanitária, respondendo pela Chefia da Unidade de abril de 2005 a abril de 2006, tendo inclusive realizado visita técnica ao Food and Drug Administration – FDA e empresas do setor a convite do Governo Americano. Desenvolveu inúmeras atividades, destacando-se entre elas: vigilância sanitária e licitação pública; inspeção sanitária em empresas com atividades na produção e/ou distribuição de produtos para a saúde; estudos normativos; reuniões técnicas; processo administrativo sanitário; pareceres técnicos; palestras; atendimento a empresas; auditoria em sistema da qualidade para verificação das boas práticas de fabricação de produtos para saúde em empresas, no Brasil e no exterior, e boas práticas de armazenamento e distribuição em importadoras e distribuidoras de produtos para saúde; instrutor / coordenador em curso de capacitação de técnicos do Sistema Nacional de Vigilância Sanitária para realização de auditoria em Sistema de Gestão da Qualidade – SGQ e Boas Práticas de Fabricação (BPF) e Boas Práticas de Fabricação. Data e Local do Seminário: Dia 28 de junho de 2011: Curso 1 das 08:00 às 12:00 horas e Curso 2 das 14:00 às 18:00 horas Local: CAERJ – Câmara do Comércio e Indústria do Estado do Rio de Janeiro Rua da Assembléia, n°77 – 3° andar – Centro. Luiz Eduardo Costa Inscrições: Faça a sua pré-inscrição para este evento através do e-mail [email protected] VAGAS LIMITADAS. Formado em Engenharia Eletrônica pelo CEFET/RJ (1985), com Mestrado em Engenharia Biomédica pelo PEB/COPPE/UFRJ (1992). Fez ainda MBA em Marketing Estratégico pela EBAP/FGV - RJ (1998). Possui também pós-graduação em Administração Hospitalar pelo Centro de Pós-Graduação São Camilo/RJ (2001) e outra pós em Engenharia Econômica pela Universidade Estadual do Rio de Janeiro – UERJ (2003). Iniciou sua carreira em empresa multinacional alemã, de grande notoriedade pelo seu mix diversificado de produtos para a saúde (“correlatos”), na qual passou 15 anos, exercendo ao longo deste tempo diversas atividades em áreas fabris e comerciais. De outubro de 2002 até janeiro de 2005 atuou como chefe da Unidade de Tecnovigilância (UTVIG/GGTPS) da Agência Nacional de Vigilância Sanitária – ANVISA, tendo atuado também como inspetor/auditor de empresas para fins de Certificação de Boas Práticas de Fabricação de Produtos Médicos – CBPF-PM, conforme a Resolução RDC ANVISA Nº. 59, de 27 de junho de 2000. Participou como instrutor convidado, pela Agência Nacional de Vigilância Sanitária, em diversos treinamentos da Resolução RDC ANVISA Nº. 59/2000, que estabelece as Boas Práticas de Fabricação de Produtos Médicos – BPF. Atualmente também é consultor do SEBRAE/DF nas áreas de produtividade, qualidade e gestão estratégica. Investimento: R$ 250,00 por curso, manhã ou tarde. Inscrição nos dois cursos – R$ 200,00 por curso. Coffee break nos dois períodos. Você deve efetuar sua pré-inscrição até dia 20/06 pelo e-mail acima enviando nome, e-mail, telefone, profissão, empresa (se for o caso) e a opção do curso (1, 2 ou 1 e 2). Após a Pré-inscrição você receberá um e-mail com os dados da conta para depósito e quando realizado o comprovante deve ser enviado ao email da SISQUALY para efetivar sua inscrição. Será fornecido certificado. Realização: Patrocínio: 28/06/2011 (manhã) – CURSO 1 08:00 09:45h O passo a passo e os cuidados para se estabelecer uma empresa de Produtos para Saúde no Brasil. PARTE I As questões regulatórias são tão importantes e impactam de forma tão forte que devem ser previstas desde o primeiro momento de qualquer empresa, mesmo antes da elaboração do contrato social. Nesta palestra serão apresentados os principais passos para que uma empresa possa alcançar toda a legalidade necessária para operar no mercado de saúde. 09:45 10:15h Intervalo com coffe-break. 10:15 12:00h O passo a passo e os cuidados para se estabelecer uma empresa de Produtos para Saúde no Brasil. PARTE II As questões regulatórias são tão importantes e impactam de forma tão forte que devem ser previstas desde o primeiro momento de qualquer empresa, mesmo antes da elaboração do contrato social. Nesta palestra serão apresentados os principais passos para que uma empresa possa alcançar toda a legalidade necessária para operar no mercado de saúde. 28/06/2011 (tarde) – CURSO 2 Fabricante ou Importador? Qual o melhor? 14:00 15:45h 15:45 16:15h Num momento de aquecimento da economia, num momento em que a economia e o mercado de saúde tornam-se cada vez mais globalizados, qual a melhor opção para operar no Brasil? Como fabricante ou importador? Serão apresentadas as questões regulatórias decisivas necessárias para uma escolha consciente. Intervalo com coffe-break. RDC 25/2009! Como minimizar seus impactos, principalmente os financeiros? 16:15 18:00h Como a adoção da RDC 25/2009, que trata da Certificação de Boas Práticas de Fabricação Internacional, pode afetar para melhor ou para pior os negócios de uma empresa de produtos para a saúde no Brasil? Nesta palestra serão apresentados os aspectos relacionados regulatórios, econômicos e algumas sugestões de como reduzir seus impactos na estratégia do negócio.
Baixar