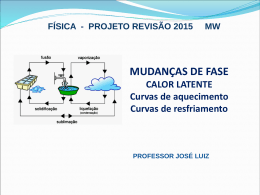
Água e Termodinâmica Alice Newton Molécula de água • covalente • Polar • momento dipolar • dois pares de electrões no O • repulsão, angulo ~ 105º • atracção intermolecular • ligações (pontes) de H (Russell cap 12) • importantes consequências • propriedades especiais da água Estrutura da água Gelo: o estado sólido • diferentes nos estados s,l,g • (s), gelo, estrutura cristalina (ver folha) densidade (s) <( l) • na formação de gelo em águas naturais, o sais são inicialmente excluídos da matriz, portanto a concentração do soluto no liquido aumenta Millero & Sohn cap.4 Água no estado liquido • Algumas moleculas aglomeradas • Alguns característicos cristalinos • Algumas moleculas individuais • Estrutura mais compacta c.f. gelo densidade (l) > (s) (ver folha) Vapor: Água no estado gasoso • Todas as ligações intermoleculares são quebradas (pontes de H) • Expansão até encher o volume disponivel • Pressão aumenta com temperatura ~ leis dos gases Propriedades especiais da água • efeitos globais, efeitos na química • termodinâmica • soluções • gases • equilibrio químico • Open University: Seawater... • Millero & Sohn: Chemical Oceanography Água e água do mar • Água é componente principal da água do mar • no entanto... água pura tem um comportamente muito diferente comparado com água do mar • o comportamento é alterado pela presença de outras substancias • 1º estudar comportamento de água pura Capacidade calorifica elevada =4,18 kJ kg -1 ºC-1 • alterações de temperatura são lentas, efeito termoestático do oceano • importantes transferências de calor por movimentos de água, efeito climático de correntes oceánicas • uniformidade de temperatura, pequena gama, estabilidade do ambiente marinho para orgamnismos Pontos de fusão • TºC 0 H2O H2Te H2Se H2S -100 Calor de fusão elevado = 333 kJ kg -1 ºC-1 • Efeito termo-estatico durante a formação e fusão do gelo especialmente importante em ambientes aquaticos de alta latitudes Calor de fusão da água • TºC 0 ~ 50 Calor adicionado (cal/g) Pontos de Ebulição • TºC 100 H2O H2Te 0 H2Se H2S Calor de evaporação elevado =2250 kJ / kg • Importante transferência de calor da água á atmosfera • Efeito moderador climático em zonas costeiras Calor de vaporização da água • TºC 100 ~ 500 Calor adicionado (cal/g) Entalpia e água 100• Pe ~500 > Hvap TºC Cc 1,0 cal/g 0 Pf ~50 Hfus Cc 0,5 cal/g > Cal/g Expansão térmica • densidade e volume do gelo e da água • densidade gelo < densidade max. da água • Estratificação térmica em ambientes aquaticos Tensão superficial elevada = 7,2 x 109 Nm-1 • Controla processos superficiaís, Processos das interfaces água / atmosfera água / organismo fisiologia celular • Importante na formação de gotas Constante dielectrica elevada (80 as 20ºC) • Importante na solubilização de iõs de sais ionicos, e formação de electrolítos • água tem elevado poder de solubilização, é considerada “solvente universal” (no entanto muitas substâncias não são soluveis na água • erosão de rochas e composição de águas naturais Grau de dissociação baixo • água contem H+ e OH- mas o grau de dissociação é baixo • H+ e OH- importantes em processos geologicos e biologicos • água pura é neutra, no entanto forma soluções acidas e basicas • efeito tampão da água do mar Transparência elevada • Energia absorvida nos UV e IR (IV) • importante em processos físicos (optica), químicos (fotoquímica), e biologicos (fotossintese) • Produção primaria, pigmentos fotossinteticos, macro e microalgas Conductividade calorifica elevada • Só importante em processos de microescala, por ex. processos celulares e organismos unicelulares Compressibilidade • “distância” intermolecular • relação inversa com temperatura (0º-50ºC) • alteração de propriedades termoquímicas (p.ex. solubilidade) com temperatura. Capacidade calorífica • relação inversa com temperatura (0º-30ºC) • propriedades térmicas diferentes c.f. outros solventes • água é solvente com propriedades especiais Viscosidade molecular relativa 10-3 Nsm-2 • fluído, diferenças de pressão compensadas facilmente • importante na física de ondas, interfaces água/água • importante na biologia especialmente pequenos organismos Termodinâmica Química • Calor, movimento, química • Abordagem: relação com caracteristicas da água e água do mar • importante no estudo de processos e espontaneidade dos processos • 2Na(s)+Cl(g)--->2 NaCl (s) é espontaneo. • 2 NaCl (s) ---> 2Na(s)+Cl(g) não é espontaneo Entalpia H • Calor absorvido durante uma transformação a pressão constante. • H = E + PV • No mar a pressão varia muito com profundidade • Processo Endotérmico absorve calor + H • Processo Exotérmico liberta calor - H Entalpia de Formação Hf • Variação de entalpia na formação de 1 mole de composto a partir de elementos livres = Hf • Na (s) + 1 Cl2(g)----> NaCl (s) 2 Hºf = - 412,1 kJmol-1 • Condições : T=298K • Pressão: 1 atm 1 2 Hºf,298 Hºf de alguns compostos • H2 O (g) • H2 O (l) • NaCl (s) • - 241,8 kJmol-1 • - 285,8 kJmol-1 • - 412,1 kJmol-1 1º Principio • “Conservação de Energia” • Diferenças de energia E podem ser atribuídas ou a • Calor adicionado: q = E = E2 - E1 ou a • Trabalho executado - W= E = E2 - E1 p.ex.: trabalho de expansão contra uma pressão externa W = Pext V Calor e trabalho • As vezes ganho de calor e execução de trabalho são simultaneos E = E2 - E1 = q = W • +Energia Ganho de Calor - Energia Execução de trabalho Calor específico • Calor necessário para aumentar de 1ºC a temperatura de 1g de substância H2 O (l) = 1,0 cal/g H2 O (s) = 0,5 cal/g • a água tem um calor específico reletivamento muito elevado Capacidade de calor molar (25ºC) • Cp: Calor necessário para aumentar de 1K a temperature de 1 mole de substância • Cp de H2 O(l) = 75,3 JK-1mol-1 Calor de fusão molar Hfus • calor necessário para a fusão de 1 mole de substância • ponto de fusão é temperatura onde ocorre a mudança de estado • H2 O (s) ----> H2 O (l) ponto de fusão = 0ºC Hfus = 6008 Jmol-1 ~50 cal/g Calor de Vaporização molar Hvap • calor necessário para a vaporização de 1 mole de substância • ponto de ebulição é temperatura onde ocorre a mudança de estado • H2 O (l) ----> H2 O (g) • ponto de ebulição = 100ºC • Hvap = 37,56 kJmol-1 ~ 500 cal g-1 2º Principio e Entropia S • “Entropia aumenta constantemente” • Entropia é uma função do estado de ordem ordem --->desordem • Moléculas de um sólido perfeito e puro a 0 K encontram-se perfeitamente ordenadas, Entropia = 0 • Entropia Padrão é entropia de 1mol de substância (25ºC) SºJK -1 mol -1 Entropia de algumas substâncias • H2 O (l) 69,9 -1 SºJK -1 mol • H2 O (g) 188,7 SºJK -1 mol -1 • H2 (g) 130,6 SºJK -1 mol -1 • O2 (g) 205,1 SºJK -1 mol -1 Espontaneidade e Energia livre • Energia “livre” para executar um trabalho que não seja expansão é chamada energia livre ou energia de Gibbs • G=H - TS G: energia de Gibbs H: entalpia T: temperatura K!!!! S: entropia Fusão da água ºC K -TS -G Jmol-1 Jmol-1 +1 274,15 -6030 -22 0 273,15 -6008 0 -1 272,15 -5986 Esp. Equil. +22 Não esp. Energia de Gibbs • G<0 • G=0 • G>0 Espontaneo Equilibrio Não espontaneo • p.ex. H2 O (s) ----> H2 O (l) é controlado pela temperatura Hfus = 6008 Jmol-1 S=21,99JK-1 mol-1 Lei de Hess • variação de entalpia depende só dos reagentes iniciais e produtos • não depende das etapas • permite calcular valores de entalpias desconhecidas a partir de valores conhecidos • construção de ciclos Born-Harber Ciclo Born-Harber vaporização da água • 1/2 H2 (g) + O2 (g)f f -241,8kJmol-1 f -285,8kJmol-1 H2 O(l) H2 O(g) crist -6,02kJmol-1 H2 O(s) Hvap Ciclo Born-Harber, entalpia reticular de NaCl • Na+ (g) Cl (g) ion+496 kJmol-1 ae-349 kJmol-1 Na+ (g) + Cl- (g) Na (g) Cl (g) diss+122kJmol-1 Na (g) 1/ 2 Cl2 (g) sub+107kJmol-1 Hret Na (s) 1/ 2 Cl2 (g) f- 411kJmol-1 Na+Cl- (s) Fusão da água ºC K -TS -G Jmol-1 Jmol-1 +1 274,15 -6030 -22 0 273,15 -6008 0 -1 272,15 -5986 Esp. Equil. +22 Não esp. Lei de Hess • variação de entalpia depende só dos reagentes iniciais e produtos • não depende das etapas • permite calcular valores de entalpias desconhecidas a partir de valores conhecidos • construção de ciclos Born-Harber Ciclo Born-Harber vaporização da água • 1/2 H2 (g) + O2 (g)f f -241,8kJmol-1 f -285,8kJmol-1 H2 O(l) H2 O(g) crist -6,02kJmol-1 H2 O(s) vap Ciclo Born-Harber, entalpia reticular de NaCl • Na+ (g) Cl (g) ion+496 kJmol-1 ae-349 kJmol-1 Na+ (g) + Cl- (g) Na (g) Cl (g) diss+122kJmol-1 Na (g) 1/ 2 Cl2 (g) sub+107kJmol-1 ret Na (s) 1/ 2 Cl2 (g) f- 411kJmol-1 Na+Cl- (s) Pontos de fusão • TºC 0 H2O H2Te H2Se H2S -100 Pontos de Ebulição • TºC 100 H2O H2Te 0 H2Se H2S Calor de fusão da água • TºC 0 ~ 50 Calor adicionado (cal/g) Calor de vaporização da água • TºC 100 ~ 500 Calor adicionado (cal/g) Entalpia e água 100• Pe ~500 > Hvap TºC Cc 1,0 cal/g 0 Pf ~50 Hfus Cc 0,5 cal/g > Cal/g
Baixar