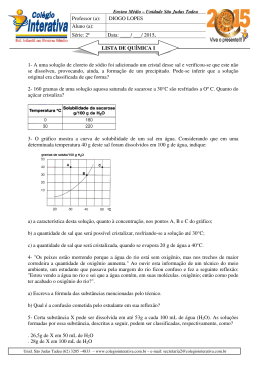
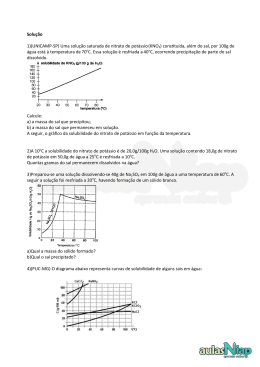
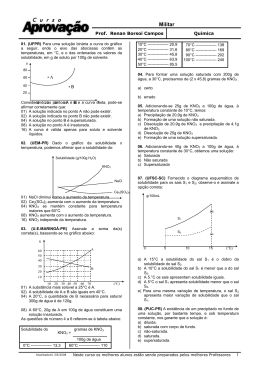
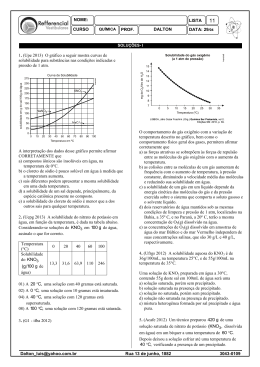
"Ensinar e aprender é o nosso OBJETIVO" COLÉGIO INTEGRADO DE OSASCO Ensino de Educação Infantil, Fundamental e Médio OBJETIVO sistema de ensino Aluno(a): Série: 2ªA/B N.º Período: Manhã Ensino: Médio Bim.: 1º Disciplina: Química Valor da Prova NOTA DEZ R.M.: Tarefa de Casa 1 Data de Entrega: 06/03/2014 1. Com referência à molécula H2S, forneça: a) Distribuição eletrônica em subníveis de cada elemento (H = 1; S = 16). b) A fórmula eletrônica. c) A fórmula estrutural. 2. A fosfina é um gás inflamável, formada por fósforo (Z=15) e hidrogênio (Z=1), e pode ser produzida na decomposição de um corpo orgânico. Assim, em cemitérios, por vezes, as pessoas se assustam quando nuvens desse gás, formado nos sepulcros, atingem a atmosfera e inflamam. Se correrem, devido ao deslocamento do ar, têm a impressão de que o fogo as acompanha, podendo-se assim levar a crença de tratar-se de espíritos ou fantasmas. Esse fenômeno é conhecido por fogo-fátuo. Com relação à fosfina (PH3), determine: a) A distribuição eletrônica em subníveis do fósforo e do hidrogênio. b) A fórmula eletrônica de suas moléculas. c) A fórmula estrutural. 3. Têm-se dois elementos químicos A e B, com números atômicos 20 e 35, respectivamente. a) Escreva as configurações eletrônicas em subníveis de A e B. b) Que tipo de ligação ocorrerá entre A e B e qual a fórmula do composto formado? 4. Sabendo que o elemento X possui número atômico 38, e o elemento Y possui 7 elétrons em sua camada de valência, forneça o tipo de ligação química e a fórmula molecular do composto formado entre esses elementos. (Neste caso, faça a distribuição eletrônica direto em camadas eletrônicas). 5. Identifique os pares de números atômicos correspondentes a elementos que quando se combinam formam o composto de fórmula A2B3. ( ) 12 e 7 ( ) 13 e 8 ( ) 19 e 16 ( ) 13 e 13 ( ) 15 e 17 OBJETIVO sistema de ensino "Ensinar e aprender é o nosso OBJETIVO" COLÉGIO INTEGRADO DE OSASCO Ensino de Educação Infantil, Fundamental e Médio 6. Um determinado sal tem coeficiente de solubilidade igual a 34g/100g de água, a 20ºC. Tendo-se 450g de água a 20 ºC, calcule a quantidade, em gramas, desse sal, que permite preparar uma solução saturada, nessa temperatura. 7. Considere as espécies químicas a seguir: Sabendo-se que as espécies A e B possuem o mesmo número de prótons (isótopos), calcule o número de massa de cada um. 8. A solubilidade do ácido bórico (H3BO3), a 20°C, é de 5g em 100g de água. Adicionando-se 200g de H3BO3 em 1,00 kg de água, a 20°C, quantos gramas de ácido re stam na fase sólida? 9. A curva de solubilidade de um sal hipotético é: Determine: a) a massa do sal que pode ser dissolvida (para formar solução saturada sem corpo de fundo) em 400 g de água a o 20 C. b) a massa aproximada do sal que precipita quando uma solução saturada preparada com 100 gramas de água é o o resfriada de 40 C a 10 C. 10. Dê exemplos e propriedades de dispersões coloidais.
Download