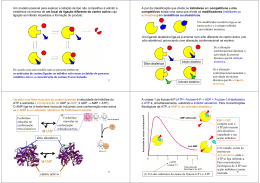
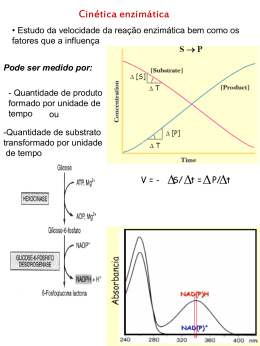
Introdução a Bioquímica: Biomoléculas Aula 6 Enzimas Ignez Caracelli Julio Zukerman Schpector BioMat – DF – UNESP/Bauru LaCrEMM – DQ – UFSCar São Carlos , 15 de setembro de 2008. 1 Nomenclatura • 1833 - Duclaux – adicionar o sufixo ase à substância sobre a qual a enzima é ativada ou indicar o tipo de rações catalisadas. • Exemplo: enzima: glutationa redutase substrato: glutationa Nomenclatura 1961 – União Internacional de Bioquímica propôs um código que divide as enzimas em 6 grandes grupos : Nomenclatura Grupo Tipos de reações catalisadas 1 Oxidoredutases Oxi-redução 2 Transferases Transferência de grupos doadores para aceptores 3 Hidrolases Clivagem de ligações, com intervenção de água 4 Liases Clivagem de ligações, sem hidrólise ou oxidação 5 Isomerases Isomerizações 6 Ligases Formação de ligações Nomenclatura • Atualmente a Enzyme Comission identifica cada enzima iniciando-as pelas letras EC seguido por um código numérico de quatro números separados por pontos. • Exemplo: EC 6.1.1.1 – Tirosina T-RNA ligase Nomenclatura 1xan 1gre glutationa redutase mas são as mesmas enzimas? Nomenclatura 1xan glutationa redutase Nomenclatura http://www.ebi.ac.uk/thornton-srv/databases/cgibin/enzymes/GetPage.pl?ec_number=1.8.1.7 Nomenclatura http://www.ebi.ac.uk/thornton-srv/databases/cgibin/enzymes/GetPage.pl?ec_number=1.8.1.7 glutationa redutase EC 1.8.1.7 Glutathione-disulfide reductase Oxidoreductases Acting on a sulfur group of donors With NAD(+) or NADP(+) as acceptor Nomenclatura 1gre glutationa redutase ???? Cofatores Cofator é um composto químico, a parte nãoprotéica ligada a uma enzima e necessária para a catálise cofator Cofatores Cofator + enzima = Holoenzima catalicamente ativo Holoenzima – Cofator = Apoenzima catalicamente inativo cofator Necessidades de cofatores (molécula não-proteíca) atuando no processo: Cofatores são geralmente metálicos: Íons • Cu2+, Fe3+ ou Zn2+ (dieta) Grupos prostéticos: • associados a enzimas covalentemente são pequenas moléculas orgânicas, nãoprotéicas que transportam grupos químicos entre enzimas. algumas vezes são chamadas de cosubstratos. não fazem parte permanente da enzima. monômero monômero FAD GSSG GSSG FAD cofator substrato GSSG FAD cofator GSSG substrato FAD substrato sítio ativo enzima homodimérica 500 aa / monômero flavoproteínas: grupo prostético → FAD coenzima: NADPH GR GSSG + NADPH + H+ → 2 GSH + NADP+ enzima GR substrato GSSG cofator coenzima FAD NADPH Ciclo da Reação Catalítica da GR a GSH ES-SE E-S-S-G f H+ GSH NADPH b EH2 + NADP+ E-S-S-G GS- e NADP+ c EH2 EH2 G-S-S-G d GSSG 24 Modelo chave-fechadura A especificidade da enzima (fechadura) para com seu substrato (chave) aumenta de acordo com a suas formas geométricas complementares. Modelo chave-fechadura Modelo chave-fechadura Interação enzima-substrato: complementaridade geométrica (necessária mas não suficiente para catálise). Modelo chave-fechadura? Modelo chave-fechadura ? Mecanismo do Ajuste Induzido Mecanismo do Ajuste Induzido Especificidade do Substrato Forças não-covalentes: › Forças de van der Walls › Interações eletrostáticas › Ligações de Hidrogênio › Interações hidrofóbicas Estereoespecificidade e Especificidade Geométrica Enzimas altamente especificas ao se ligar a substratos quirais e na catálise das suas reações; Quiralidade inerente das proteínas (L aminoácidos) formam centros ativos assimétricos; Logo, enzima com quiralidade errada não consegue se encaixar no centro ativo da enzima; Forma e quiralidade Diferenciação de forma e dos grupos funcionais : não ocorre interação não forma complexo enzima substrato. Inibidor molécula que bloqueia a ação da enzima a inibição pode ser reversível ou irreversível reversível: interações fracas irreversível: interações covalentes Inibidor os inibidores podem ser competitivos ou não-competitivos Inibidor Competitivo Tem semelhança com o substrato e compete com o substrato pelo sítio ativo da enzima substrato substrato enzima sítio ativo inibidor Inibidor não-Competitivo não entra no sítio ativo da enzima substrato substrato enzima sítio ativo inibidor Regeneração das coenzimas As coenzimas são alteradas quimicamente pela reação enzimática em que participam. Assim, para completar o ciclo catalítico, a coenzima tem de voltar ao seu estado inicial. Vitaminas • Muitos organismos não são capazes de sintetizar certas coenzimas; • Carência pode provocar uma série de doenças causadas por catálises enzimáticas incompletas. Vitaminas - A Vitaminas Princiapis fontes Sintomas da vitaminose A – Retinol ou Laticínios, cenoura, beterraba, Problemas de visão (xerofitalmia), especialmente axeroftol. espinafre, fígado, rim, gema de ovo. cegueira noturna (hemerolopia), pele escamosa e seca. Betacaroteno Brócolis, pêssego, tomate. (precursor) Ácido fólico B1 Tiamina Vegetais, laranja, nozes, legumes, Regula a divisão celular e promove o bom cereais integrais, levedura de cerveja funcionamento da célula. e fígado. Também é sintetizada em nosso corpo pelas bactérias intestinais (flora intestinal). Anemia, problemas gastrointestinais, lesões nervosas Carnes, legumes, cereais integrais, Beribéri (inflamação e degeneração dos nervos). verduras. cereais integrais, levedura de cerveja funcionamento da célula. e fígado. Também é sintetizada em nosso corpo pelas bactérias intestinais (flora intestinal). gastrointestinais, problemas Anemia, nervosas Vitaminas - B lesões B1 Tiamina Carnes, legumes, cereais integrais, Beribéri (inflamação e degeneração dos nervos). verduras. B2 – Riboflavina Laticínios, carnes, cereais, verduras. Fissuras na pele, tais como rachaduras no canto da boca (queilose). Fotofobia. B3 – Niacina nicotinamida, vitamina (preventiva pelagra) ou Nozes, carnes (ave, salmão, bovina), Atua na regulação do colesterol ou cereais (ervilha, amendoim). PP da B6 – piridoxina Carnes, verduras, cereais integrais, Atua no sistema imunológico. leite, banana, batata. Duas Maneiras de ocorrer: Controle da viabilidade enzimática : a quantidade de enzimas em uma célula da reação de síntese e de degradação. Controle da atividade enzimática : atividade catalítica da enzima pode ser diretamente regulada através de alterações estruturais e conformacionais, ex: alosteria 43 Controle Alostérico termo usado para descrever a situação em que a função da proteína em um sítio é afetada pela ligação de uma molécula regulatória em outro sítio. a regulação alostérica pode inibir ou ativar a atividade de uma enzima alterando sua forma para a forma ativa ou inativa. Controle Alostérico enzima alostérica com 4 subunidades sitio ativo ativador alostérico um dos 4 sítios regulatórios ativador forma ativa estabilizada a ligação do ativador alostérico estabiliza a forma ativa da enzima Controle Alostérico a ligação do inibidor alostérico estabiliza a forma inativa da enzima forma inativa estabilizada inibidor alostérico sitio ativo nãofuncional inibidor Controle Alostérico enzima alostérica com 4 subunidades sitio ativo ativador alostérico um dos 4 sítios regulatórios ativador oscilação inibidor alostérico sitio ativo nãofuncional inibidor
Download







![+ [E] [S] - Sistemas EEL - Universidade de São Paulo](http://s1.livrozilla.com/store/data/000150897_1-f33431079ef06af434a6636d8f76dc77-260x520.png)




