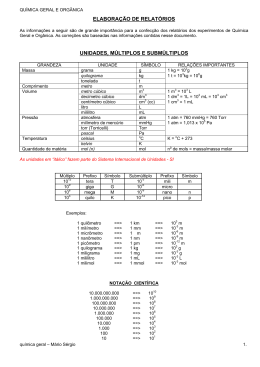
Química Aplicada ao Ambiente CET: ESTTQA-TMR1 Classificação da Matéria e Medições Valentim M B Nunes Unidade Departamental de Engenharias Instituto Politécnico de Tomar, Fevereiro,2014 Química: a Ciência Central QUÍMICA Engenharia Química Engenharia do Ambiente Geologia Geoquímica Agricultura Química Nuclear Química Física Medicina Física Bioquímica Ciência dos Materiais Biologia Astronomia Conceitos básicos Química - É uma Ciência experimental que se ocupa do estudo da Matéria e das transformações que nela ocorrem. Matéria: Tudo o que possui massa e ocupa espaço. Substância pura: forma de matéria com composição bem definida e propriedades próprias. Exº: H2O, ouro, O2, etc.. Elementos: blocos básicos da matéria! Não podem ser decompostos por meios químicos em substâncias mais simples Compostos: combinação de dois ou mais elementos unidos quimicamente em proporções bem definidas e constantes. Misturas: combinação de duas ou mais substâncias que mantêm a sua identidade. Homogéneas: Constituídas por uma única fase uniforme Heterogéneas: múltiplas fases. Classificação da matéria Transformações físicas: a identidade das substâncias não é alterada. Transformações químicas: formação ou quebra de ligação química. Exercício 1. Classifique em elementos ou compostos as seguintes substâncias: a) hidrogénio; b) água; c) ouro; d) metano Exercício 2. Classifique em elementos ou compostos as seguintes substâncias: a) dióxido de carbono; b) oxigénio; c) flúor; d) octano Exercício 3. Classifique em elemento, composto, mistura homogénea ou heterogénea: a) gasolina; b) óleo usado; c) árgon gasoso; d) água oxigenada Elementos Tabela Periódica Estados da matéria Todas as substâncias podem, em princípio, existir em três estados de agregação: sólido, liquido ou gás. Medição A medição é o acto que implica a determinação do valor de uma grandeza a medir, afectada de um erro de exactidão ou incerteza. A ciência que rege a medição é a metrologia. Propriedades macroscópicas: medição directa como por exemplo a massa (balança) ou o volume (buretas, pipetas, etc…) Propriedades microscópicas: medição indirecta, como as propriedades atómicas ou moleculares. Propriedades intensivas: não dependem da quantidade de matéria: exº densidade, temperatura… Propriedades extensivas: dependem da quantidade de matéria: exº massa, volume… Unidades do Sistema Internacional (SI) Unidades de Base Grandeza Unidade SI Símbolo Comprimento metro m Massa quilograma kg Tempo segundo s Corrente eléctrica ampére A Temperatura kelvin K Quantidade de matéria mole mol Unidades derivadas: exº volume (m3); força (N); energia (J), etc. T ( K ) t (º C ) 273.15 Prefixos do SI Prefixo símbolo significado exemplo giga G 1 000 000 000 ou 109 1 GJ = 1x109 J mega M 1 000 000 ou 106 1 MJ = 1x106 J quilo k 1000 ou 103 1 kg = 1x103 g deci d 1/10 ou 10-1 1dg = 1x10-1 g centi c 1/100 ou 10-2 1cm = 1x10-2 m mili m 1/1000 ou 10-3 1 mm = 1x10-3 m micro μ 1/1 000 000 ou 10-6 1 μg = 1x10-6 g nano n 1/ 1 000 000 000 ou 10-9 1 nm = 1x10-9 m pico p 1/ 1 000 000 000 000 ou 10-12 1 pm = 1x10-12 m Volume A unidade derivada do SI para volume é o m3. Os químicos trabalham normalmente com volumes mais pequenos. 1 cm3 (1102 m)3 1106 m3 1 dm 3 (1101 m)3 1103 m3 Uma outra unidade comum, não SI, é o litro. 1 L 1000mL 1000cm3 1 dm 3 Densidade A equação para a densidade é: massa volume Density - an Intensive, Physical Property • For Most materials, density decreases with temperature as the volume increases -- not so for water If the density of ice at 0° C is 0.917 g / ml how much mass of ice is there in 75 ml of ice? Exercício 4. A densidade do etanol é 0.798 g/mL. Qual a massa de 17.4 cm3 de etanol? Exercício 5. A densidade do mercúrio, o único metal liquido à temperatura ambiente, é 13.6 g/mL. Qual a massa de 5.5 mL de mercúrio? Exercício 6. A temperatura normal do corpo humano é 37 ºC. Qual a temperatura no SI em kelvin? Exercício 7. O bromo é um liquido avermelhado. Calcular a sua densidade se 586 g de substância ocuparem 188 mL. Exercício 8. A temperatura de fusão do chumbo é 327.5 ºC. Qual a temperatura em kelvin? Algarismos Significativos A contagem de algarismos significativos faz-se da esquerda para a direita, pelo primeiro algarismo diferente de zero. Eis alguns exemplos: 145 3 algarismos significativos 1.006 4 algarismos significativos. 0.005 1 algarismo significativo. 2.00 3 algarismos significativos. Para números sem casas decimais, os zeros podem ou não ser significativos. Por exemplo 600 pode ter 1,2 ou 3 algarismos significativos. Para eliminar esta ambiguidade deve usar-se a notação científica: 6.00x102 corresponde a 3 algarismos significativos Notação Científica: mx10e m – mantissa maior que 1 e menor que 10 e – ordem de grandeza Algarismos Significativos Soma e subtracção: resultado não pode ter mais dígitos à direita da virgula do que qualquer dos números originais. Exemplos: 0.0123 + 0.12 = 0.1323 = 0.13 (2 casas decimais) 89.332 + 1.1 = 90.432 = 90.4 (1 casa decimal) 20.35 – 20.2 = 0.15 = 0.2 (1 casa decimal) 2.097 – 0.12 = 1.977 = 1.98 (arredonda para 1.98 com 2 casas decimais) Multiplicação e divisão: resultado apresenta-se com o nº de algarismos significativos correspondente ao valor com menor número de algarismos significativos. Exemplos: 0.7x2.00 = 1.4 = 1 13.256/1.30 = 10.1969… = 10.2 2.8x4.5039 = 12.61092 = 13 Etc.. Em cálculos intermédios mantêm-se mais algarismos. Valores exactos não devem ser considerados! Definições associadas à medição Exactidão e precisão Exactidão – está relacionada com a proximidade entre o valor medido e o valor verdadeiro da grandeza medida. Pode avaliar-se pelo cálculo do erro absoluto ou do erro relativo: Ea valor medido - valor verdadeiro Er Ea 100 valor verdadeiro Precisão – está relacionada com a proximidade entre si dos vários valores medidos. Pode avaliar-se pelo cálculo do desvio-padrão, s, em que n é o número de medições: __ 2 xi x s i 1 n 1 n Método do factor unitário Para converter entre unidades na resolução de problemas químicos usaremos a análise dimensional ou o chamado método do factor unitário. Em geral usamos a relação: unidade dada unidade desejada unidade desejada unidade dada Factor unitário! Exemplo: Converter a densidade da água 0.998 g/mL em kg/m3 (SI) 1 kg 1106 mL -3 0.998g.mL 998 kg.m 3 1000g 1 m -1 Exercício 9. Calcular o número de segundos num ano solar (365.24 dias) Exercício 10. O limite de velocidade nas auto-estradas em Portugal é 120 km/h. Converta para o SI. Exercício 11. O cloro é usado para desinfectar piscinas. A concentração para esse feito deve ser 1 ppm ou seja 1g de cloro para cada milhão de gramas de água. Calcular o volume de solução de cloro a 6% em massa que se deve usar numa piscina contendo 2x104 galões de água ( 1 galão = 3.79 L; ρ = 1 g/mL). Exercício 12. O monóxido de carbono, CO, é um gás venenoso porque se liga fortemente à hemoglobina transportadora de oxigénio no sangue. Uma concentração de 8x102 ppm por volume de CO é considerada letal para os seres humanos. Calcular o volume, em litros, ocupado pelo CO numa sala que mede 17.6 m de comprimento, 8.8 m de largura e 2.64 m de altura com esta concentração.
Download