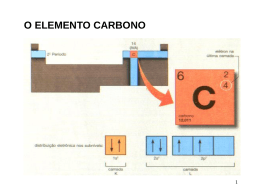
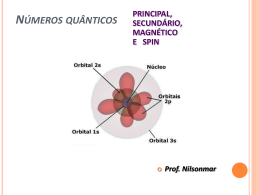
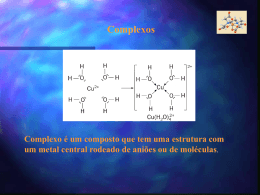
Ligações Químicas: Parte II Conteúdo • • • • • • • O Que se Espera de uma Teoria de Ligação Introdução ao método da Ligação de Valência Hibridização de Orbitais Atômicos Ligações Covalentes Múltiplas Teoria de Orbitais Moleculares Elétrons Delocalizados: As Ligações na Molécula de Benzeno. Ligações em Metais Por Quê São Necessárias Novas Teorias de Ligação? •A teoria de Lewis apresenta alguns problemas: •Ela não explica a existência de condutores ou semicondutores. •São necessárias abordagens mais sofisticadas: •Hibridização •Orbitais moleculares a partir de orbitais atômicos. O Que Se Espera de Uma Teoria de Ligação? • Aproxima-se os átomos, vindos do infinito. – Os elétrons são atraídos por ambos os núcleos. – Os elétrons se repelem – Os núcleos se repelem • Constrói-se um gráfico de energia potencial versus distância. – Energias negativas → forças de atração – Energias positivas → forças de repulsão Diagrama de Energia Potencial Introdução ao Método da Ligação de Valência • Orbitais atômicos descrevem as ligações covalentes • A área de interpenetração (overlap) dos orbitais está em fase. • É um modelo localizado de ligação. Ligações emH2S Átomos isolados Ligações covalentes Os orbitais de ligação estão em cinza Exemplo 1 Usando o método da ligação de valência para descrever uma estrutura molecular. Descreva a molécula de fosfina, PH3, pelo método da ligação de valência Identifique os elétrons de valência: Exemplo 1 Esboce os orbitais: Faça o overlap dos orbitais: Descreva a forma: são 92-94° Piramidal trigonal (os ângulos observados Hibridização de Orbitais Atômicos Estado Fundamental Estado Excitado O número de orbitais hibridizados é igual ao de orbitais atômicos Hibridização sp3 Hibridização sp3 Ligações no Metano Hibridização sp3 no Nitrogênio Ligações no Nitrogênio Hibridização sp2 Orbitais no Boro Combine para gerar três orbitais sp2 Que são representados pelo conjunto Hibridização sp Orbitais no Berílio Combine para gerar três orbitais sp Que são representados pelo conjunto Hybridização sp3d e sp3d2 Orbitais sp3d Orbitais sp3d2 Estrutura bipiramidal trigonal Estrutura octaédrica Orbitais Híbridos e VSEPR • Escreva uma estrutura de Lewis plausível. • Use a VSEPR para prever a geometria eletrônica. • Escolha a hibridização apropriada. Ligações Covalentes Múltiplas • O etileno possui uma ligação dupla em sua estrutura de Lewis. • VSEPR: carbono trigonal planar Etileno Conjunto de orbitais sp2 + p Ligações sigma () Overlap de orbitais p origina uma ligação pi () Acetileno • O Acetileno, C2H2, possui uma ligação tripla. • VSEPR: carbono linear. Formação de ligações Formação de ligações Teoria de Orbitais Moleculares • Os orbitais atômicos estão isolados nos átomos. • Orbitais moleculares incluem dois ou mais átomos • Obtidos através de LCAO (CLOA): – Combinação Linear de Orbitais Atômicos. Ψ1 = φ1 + φ2 Ψ2 = φ1 - φ2 Combinação de Orbitais Atômicos Adição Subtração Orbitais moleculares ligantes e antiligantes Orbitais Moleculares do Hidrogênio Plano Nodal Antiligante Orbitais 1s de Dois átomos de hidrogênio separados Ligante Orbitais moleculares da molécula de H2 Densidade de carga eletrônica (probabilidade) ao longo de uma linha ligando os dois átomos Diagrama de níveis de energia Idéias Básicas a Respeito de OMs • Número de OAs= número de OMs. • Há sempre a formação de OMs ligantes E antiligantes a partir do OAs. • Os elétrons ocupam primeiro o OM de mais baixa energia. • O princípio da exclusão de Pauli se aplica: – O número máximo de elétrons por OM é dois. • A regra de Hund se aplica: – Oms degenerados são preenchidos antes do emparelhamento. Ordem de Ligação • Espécies estáveis possuem mais elétrons em orbitais ligantes do que em orbitais antiligantes No. e- em OMs Ligantes - No. e- em OMs Antiligantes Ordem de Ligação= 2 Moléculas Diatômicas do Primeiro Período OL = (e-lig - e-antilig )/2 OLH += (1-0)/2 = ½ 2 OLH += (2-0)/2 = 1 2 OLHe + = (2-1)/2 = ½ 2 OLHe + = (2-2)/2 = 0 2 Electronic Configuration of H2-type Molecules From the previous theory, we can fill the M Os with electrons for the H2-type molecule: Molecule H2+ H2, He22+ H2–, He2+ H22–, He2 e-configuration 1 (11) 12 12 1* 12 1*2 Bond order ½ 1 ½ 0 bondlength 106 pm 74, ~75 ~106, 108 not formed Describe the relationships of bondlength & bondorder and e-configurations; learn to reason Theories of chemical bonding Orbitais Moleculares do Segundo Período • O primeiro período só utiliza orbitais 1s. • No segundo período há orbitais 2s e 2p disponíveis. • Overlap de orbitais p: – Overlap terminal é mais efetivo – ligação sigma (σ). – Overlap lateral é bom – ligação pi (π). Orbitais Moleculares do Segundo Período Combinações de Orbitais p (antiligante) (ligante) (antiligante) (ligante) (antiligante) (ligante) Diagrama de OM Esperado Para C2 Diagrama de OM Modificado ParaC2 Diagramas de OM Para Moléculas Diatômicas do 2o. Período. Diagramas Para Moléculas Diatômicas Heteronucleares Elétrons Delocalizados Benzeno Esquema das ligações Esquema das ligações Representação simbólica Benzene The benzene structure has fascinated scientists for centuries. It’s bonding is particularly interesting. The C atom utilizes sp2 hybrid AO in the sigma bonds, and the remaining p AO overlap forming a ring of p bonds. Sigma bonds are represented by lines, and the p orbitals for the bonds are shown by balloon-shape blobs. Note the + and – signs of the p orbitals. Thus, we represent it by + + + + + + – – – Theories of chemical bonding – More About Benzene Theories of chemical bonding 42 Flávio Vichi, QFL-137, 2007 Benzeno Orbitais antiligantes Orbitais ligantes Ozônio Esquema das ligações Orbital molecular delocalizado Ligações em Metais • Modelo do mar de elétrons – Núcleos em um mar de e-. – Brilho metálico. – Maleabilidade. Força aplicada Ligações em Metais Teoria de Bandas. • Extensão da TOM: N átomos originam N orbitais de energia muito próxima. • N/2 são preenchidos. A banda de valência. • N/2 ficam vazios. A banda de condução. Banda de Energia Teoria de Bandas Metal Metal Semicondutor Isolante Semicondutores • Semicondutores intrínsecos: band gap fixo. • Ex: CDs, absorve luz violeta e parte da azul, e reflete a luz menos energética: aparência amarelo brilhante. • GaAs: band gap pequeno, toda a luz visível é absorvida: preto. Semicondutores • Semiciondutores extrínsecos: o band gap é controlado através da adição de impurezas: dopagem. • O nível de energia do P fica logo abaixo da banda de condução do Si. P usa 5 elétrons para se ligar ao Si, e o excedente pode ser doado. • Semicondutor do tipo n se refere a negativo, o tipo de carga que é MÓVEL. • O nível de energia do Al fica logo acima da banda de valência do Si. Elétrons podem entrar no orbital do Al, deixando um BURACO na banda de valência. A carga positiva pode se mover e este é portanto um semicondutor tipo p. Semicondutores Banda de Banda de condução condução Nível doador Nível aceptor Banda de Banda de valência valência Semicondutor tipo n Semicondutor tipo p Células Fotovoltaicas Luz solar Silício tipo p Silício tipo n
Download