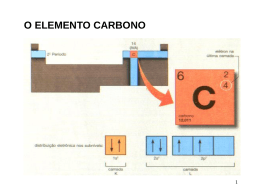
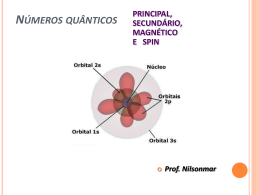
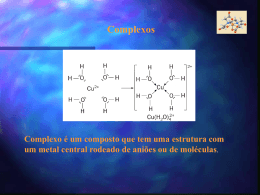
CAPÍTULO 9 Geometria das Moléculas e Teoria das Ligações Grupo:Michael Felipe Guarizo (EEL/17114) Rodrigo Davy Vaz de Oliveira Braga (EEL/17127) Hélio Hideki Takigone (EEL/17119) Prof. Élcio 1 Geometria das moléculas A estrutura de Lewis só nos fornece o número e o tipo de ligação que determinada molécula realiza. A forma espacial que tal molécula adquire no espaço, é determinada por seus ângulos de ligação, gerado pela repulsão dos elétrons (ligantes e não ligantes) presentes na camada de valência dos átomos, dando uma geometria 3D à molécula. Prof. Élcio 2 Geometria molecular Existem 5 tipos de geometria fundamentais que obedecem o esquema ABn para a distribuição espacial Prof. Élcio 3 Geometria molecular 5-Octaédrica ou bipiramidal tetragonal (presente em moléculas com seis nuvens eletrônicas na camada de valência do átomo central, e todas realizam ligação). SF6 Prof. Élcio 4 Geometria molecular 4-Bipiramidal trigonal (presente em moléculas com cinco nuvens eletrônicas na camada de valência do átomo central, e todas realizam ligações). SF4 Prof. Élcio 5 Geometria molecular 3-Tetraédrica (presente em moléculas com quatro nuvens eletrônicas na camada de valência do átomo central, e todas realizam ligações). CH4 Prof. Élcio 6 Geometria molecular 2-Trigonal Plana ou Triangular (presente nas moléculas em que o átomo central possui três nuvens eletrônicas em sua camada de valência, e todas realizam ligações). SO3 Prof. Élcio 7 Geometria molecular 1-Linear (presente em todas as moléculas biatômicas ou em moléculas em que o átomo central possua no máximo duas nuvens eletrônicas em sua camada de valência, e todas realizam ligações). CO2 Prof. Élcio 8 Casos particulares (angular e piramidal) Angular (moléculas que possuem par de elétrons não ligantes no átomo central). H2O Prof. Élcio 9 Casos particulares (angular e piramidal) Piramidal (moléculas com quatro nuvens eletrônicas no átomo central, mas apenas três realizam ligações). NH3 Prof. Élcio 10 Modelo RPENV Para determinar a geometria que a molécula adquire, usamos os pares de elétrons ligantes e não ligantes, determinados pela forma estrutural de Lewis. A molécula adquire a geometria em que a repulsão entre seus elétrons seja a mínima possível. Prof. Élcio 11 Modelo RPENV Efeito dos elétrons não-ligantes e ligações múltiplas nos ângulos de ligação. Uma molécula pode adquirir a mesma geometria que outra molécula, mas não necessariamente devem ter o mesmo ângulo de ligação. Isso ocorre devido aos pares de elétrons não-ligantes serem atraídos por um único núcleo, gerando uma força repulsiva maior entre os adjacentes, comprimindo o ângulo de ligação. Prof. Élcio 12 Modelo RPENV Moléculas com expandidos níveis de valência *Moléculas com cinco nuvens eletrônicas, tendem a se estabilizar quando adquirem a geometria bipiramidal trigonal *Moléculas com seis nuvens eletrônicas, tendem a se estabilizar quando adquirem a geometria bipiramidal tetragonal Prof. Élcio 13 Modelo RPENV Prof. Élcio 14 Modelo RPENV Formas espaciais de moléculas maiores Atribuímos a geometria ao redor de cada átomo central separadamente CH3COOH (ácido acético) Prof. Élcio 15 Polaridade Linha de eletronegatividade Prof. Élcio 16 Polaridade Existe uma diferença de eletronegatividade entre as moléculas. A essa diferença damos o nome de momento de dipolo. Prof. Élcio 17 Polaridade Os momentos de dipolo são grandezas vetoriais, portanto, uma molécula pode ter ligações polares e ser apolar, ou seja, se o momento de dipolo resultante for zero, dizemos que a molécula é apolar, mas se o momento de dipolo resultante for diferente de zero, a molécula é polar. Prof. Élcio 18 Polaridade Concluímos então que a polaridade da molécula depende de sua geometria Apolar – CO2 Prof. Élcio 19 Polaridade Polar – H2O Momento de dipolo total ‡ 0 Prof. Élcio 20 Polaridade Prof. Élcio 21 Ligação covalente e superposição de orbitais Teoria da ligação de Valência A teoria tenta explicar a ocorrência de ligações covalentes entre átomos. Esta ocorreria através da superposição de orbitais atômicos semi-preenchidos de átomos distintos que se ligariam, sendo que esta superposição causaria o aumento da densidade eletrônica entre os núcleos. Prof. Élcio 22 Ligação covalente e superposição de orbitais Relação entre a distância de átomos ligantes e a energia potencial Prof. Élcio 23 Orbitais híbridos Para explicarmos as geometrias de moléculas poliatômicas, freqüentemente supomos que os orbitais atômicos em um átomo se misturam para formar orbitais híbridos. Prof. Élcio 24 Orbitais híbridos Prof. Élcio 25 Orbitais híbridos Hibridização é o processo pelo qual se combinam orbitais atômicos durante a aproximação dos átomos ligantes. O número de orbitais híbridos é igual ao número de orbitais atômicos que se misturam. Os orbitais híbridos tem regiões maiores do que os orbitais que o formaram. Prof. Élcio 26 Orbitais híbridos Orbitais Híbridos sp São orbitais formados pela mistura de um orbital s e um orbital p, sendo que ambos os orbitais devem conter elétrons desemparelhados. Usamos a estrutura eletrônica do Be: Prof. Élcio 27 Orbitais híbridos Prof. Élcio 28 Orbitais híbridos Orbitais híbridos sp2 e sp3 Os orbitais sp2 são coplanares afastados 120º. É responsável pela geometria trigonal plana. Os orbitais sp3 apontam em direção aos vértices de um tetraedro. Prof. Élcio 29 Orbitais híbridos Prof. Élcio 30 Orbitais híbridos Hibridização com orbitais d É possível com átomos do 3º período ou subsequentes, e segue a mesma lógica mostrada para os outros orbitais híbridos. Prof. Élcio 31 Orbitais híbridos sp3d – bipirâmide trigonal sp3d2 - octaedro Prof. Élcio 32 Ligações múltiplas Ligação sigma e pi A ligação sigma corresponde a uma ligação direta entre os átomos, ou seja, os orbitais cruzam a reta que une os núcleos atômicos. Já a ligação pi corresponde a uma ligação lateral entre os orbitais atômicos; os orbitais dessa ligação são perpendiculares à reta internuclear. Os orbitais correspondentes a pi são menos estáveis que os orbitais sigma. Uma ligação sigma corresponde em geral a uma ligação simples Uma ligação sigma e uma pi formam uma ligação dupla Uma ligação sigma e duas pi formam uma ligação tripla Prof. Élcio 33 Ligações múltiplas Ligações pi delocalizadas Prof. Élcio 34 Teoria do Orbital Molecular Maneira mais complexa e atual de se considerar os orbitais nas moléculas. Suponha que orbitais atômicos puros dos átomos na molécula combinam-se para produzir orbitais que são espalhados ou delocalizados sobre diversos átomos ou mesmo sobre uma molécula inteira. Esses novos orbitais são os orbitais moleculares. Um exemplo de aplicação é a previsão dos orbitais moleculares que dão a estrutura eletrônica da molécula de O2, que não segue a suposição de emparelhamento de elétrons da abordagem de Lewis. Prof. Élcio 35 Princípios da Teoria do Orbital Molecular O número total de orbitais moleculares é sempre igual ao número total de orbitais atômicos fornecidos pelos átomos que combinaram. O orbital molecular ligante tem menor energia do que os orbitais atômicos originais, e os orbitais anti-ligantes são de maior energia. Prof. Élcio 36 Princípios da Teoria do Orbital Molecular Os elétrons da molécula são atribuídos aos orbitais de energia cada vez maior, de acordo com o principio da exclusão de Pauli e o princípio da maior multiplicidade de Hund. Os orbitais atômicos combinam-se para formar orbitais moleculares de forma mais eficaz, quando os orbitais atômicos possuem energias semelhantes. Prof. Élcio 37 Orbitais moleculares para H2 Os orbitais dos dois átomos do H2 se sobrepõem formando assim 2 orbitais moleculares Orbital molecular resultante da adição: O.M. ligante Orbital molecular resultante da subtração: O.M. anti-ligante Prof. Élcio 38 Teoria do Orbital Molecular Prof. Élcio 39 Teoria do Orbital Molecular Prof. Élcio 40 Ordem de ligação para Teoria do Orbital Molecular Número líquido de pares de elétrons de ligação unindo um par de átomos. Ordem de ligação = ½ (nº de e- em O.M. ligantes – nº de e- em O.M. anti-ligantes) A estabilidade da ligação está relacionada à ordem de ligação. Quanto maior a ordem de ligação mais estável a ligação. Prof. Élcio 41 Orbital Molecular de Li2 Os elétrons ơ1s e ơ1s* se anulam em relação a estabilizar a ligação. A ligação deve-se ao par de elétrons atribuídos ao orbital ơ2s . Ordem de ligação (OL) = 1 Prof. Élcio 42 Teoria do Orbital Molecular Prof. Élcio 43 Orbital Molecular de Be2 Provavelmente não existe, pois todos os elétrons se cancelam para estabilizar a ligação, assim não há ligação líquida. OL = 0 Prof. Élcio 44 Orbitais Moleculares dos orbitais atômicos 2p Quando os orbitais 2p se sobrepõem, seis orbitais moleculares resultam da combinação: Um orbital ơ e um ơ*, resultante da interação de dois orbitais de cada átomo. Prof. Élcio 45 Orbitais Moleculares dos orbitais atômicos 2p Dois orbitais π e dois orbitais π*, resultantes da interação de dois orbitais de cada átomo. Quando ocorrem interações entre os orbitais “s” e “p” do mesmo nível, a ordem de energia dos orbitais moleculares pode se alterar. Prof. Élcio 46 Orbitais Moleculares dos orbitais atômicos 2p Prof. Élcio 47 Orbitais Moleculares dos orbitais atômicos 2p Prof. Élcio 48 Configurações eletrônicas e propriedades moleculares Quanto ao comportamento das moléculas em um campo magnético, elas podem apresentar: Prof. Élcio 49 Configurações eletrônicas e propriedades moleculares Paramagnetismo: possuem elétrons não emparelhados, sendo assim fortemente atraídas pelo campo magnético. Prof. Élcio 50 Configurações Eletrônicas e Propriedades Moleculares Diamagnetismo: não possuem elétrons desemparelhados, sendo assim fracamente repelidas pelo campo magnético. Prof. Élcio 51 Configurações eletrônicas e propriedades moleculares À medida que a distância de ligação diminui, a ordem de ligação e a energia de dissociação da ligação aumentam. Prof. Élcio 52 Orbitais Moleculares dos orbitais atômicos 2p Prof. Élcio 53 Configurações eletrônicas e propriedades moleculares Prof. Élcio 54 Referência bibliográfica Livro Química a Ciência Central Prof. Élcio 55
Download