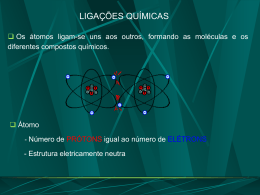
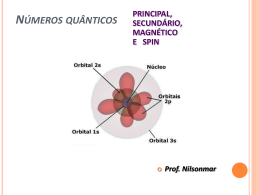
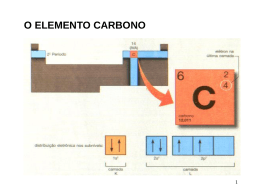
• Marina Couto – 14415 • Muriel Monteiro – 14418 Introdução: • A geometria molecular determina a ocupação da molécula no espaço. • O arranjo espacial da molécula e a polaridade de suas ligações influi diretamente nas propriedades físicas do material formado por ela. 9.1 Formas espaciais moleculares • Os átomos se arranjam na molécula de forma a se manterem mais afastados possível devido às forças de repulsão eletrônica. • As formas mais comumente encontradas que apresentam átomos semelhantes ligados a um único átomo central são: linear, angular, trigonal piramidal, trigonal plana, tetraédrica, bipiramidal trigonal e octaédrica. • Domínio de elétrons é a região onde, provavelmente os elétrons serão encontrados. Em uma molécula esse domínio pode ser : • um par ligante, que faz uma ligação química com outro átomo. • um par não-ligante que não se liga a outro átomo, mas mesmo assim, sofre repulsão dos outros pares interferindo no formato espacial de uma molécula. • Basicamente, pode-se determinar a forma espacial ao saber a quantidade de domínios de elétrons e a quantidade de pares ligantes. • Sabe-se que os domínios de elétrons tem que se afastar o máximo que puderem para minimizar suas repulsões. • Porém o arranjo será definido pela distribuição dos átomos e não pela distribuição dos domínios de elétrons. • Usando essas informações, pode-se determinar facilmente o arranjo de qualquer molécula. Exemplos: • CO2 e SO2; ambas tem um átomo central ligado a outros dois átomos. Porém em qualquer livro se encontra que o CO2 é linear e o SO2 é angular. Por que? • No CO2 todos os domínios de elétrons do átomo central foram usados para ligar o carbono ao oxigênio. Há então apenas dois domínios de elétrons. Sendo assim, para minimizar a repulsão, eles ficarão o mais afastados possível. Isso acontece, quando o ângulo entre eles for de 180º, definindo uma molécula linear. • Já no SO2, há 3 domínios de elétrons. Para minimizar as repulsões, esses 3 domínios ficarão igualmente afastados, determinando um ângulo de 120º entre eles. Porém, só dois ligam o hidrogênio ao oxigênio, formando assim uma molécula angular. CO2 SO2 Polaridade • Definição: é uma medida de quão igualmente os elétrons em certa ligação são compartilhados entre os dois átomos da ligação. • À medida que a diferença na eletronegatividade aumenta, aumenta também a polaridade. • A separação de cargas nas moléculas tem efeito significativo nas propriedades físicas e químicas. Momento de dipolo • É definido pela polaridade dos átomos ligantes da molécula e sua geometria molecular. • Uma molécula pode ser apolar mesmo sendo composta de ligações polares. O momento dipolo e os dipolos de ligação são grandezas vetoriais: possuem módulo, direção e sentido. O dipolo total poliatômico é a soma dos dipolos de todas as ligações da molécula. Ligações covalentes • Teoria de Lewis: a ligação ocorre quando os átomos compartilham elétrons e a densidade eletrônica se concentra entre os núcleos. • Teoria da ligação de valência: o acúmulo de densidade eletrônica entre dois núcleos é semelhante à fusão de dois orbitais atômicos. Permite que dois elétrons de spin contrários compartilhem um espaço comum entre os núcleos, formando uma ligação covalente . Hibridização É o processo de misturar e variar os orbitais atômicos na proporção que os átomos se aproximam para formar ligações. Orbitais híbridos sp • Ocorre em moléculas de geometria linear. • Há uma excitação de um elétron do orbital s para o orbital p para formar elétrons desemparelhados e ser capaz de formar ligação covalente. • Os orbitais são misturados para que os dois elétrons desemparelhados possam formar as ligações, formando dois novos orbitais idênticos no formato mas com lóbulos de sentidos opostos. Orbitais híbridos sp2 e sp3 • Formam moléculas de geometria trigonal plana e tetraédrica. • Quando se combina certo número de orbitais atômicos, obtém-se o mesmo número de orbitais híbridos. No caso da hibridização sp2 e sp3 são formados respectivamente 3 e 4 orbitais híbridos. Ligações múltiplas • Nas ligações covalentes, podem ser formadas ligações do tipo σ ou do tipo π. • As ligações σ são aquelas nas quais a densidade eletrônica localiza-se ao longo da linha de conexão dos átomos. • As ligações π são formadas pela superposição pararela de orbitais p. Para haver a ligação π, as moléculas ligantes devem se localizar no mesmo plano, e por isso elas produzem rigidez nas moléculas. Orbitais moleculares • A teoria dos orbitais moleculares descreve os elétrons nas moléculas usando funções de onda específicas, chamadas orbitais moleculares. • Um orbital molecular, assim como o atômico, pode acomodar um máximo de dois elétrons e tem uma energia definida. • A combinação de dois orbitais atômicos leva à formação de dois orbitais moleculares, um de menor energia e outro de maior, chamados respectivamente de: • Orbital Molecular Ligante. É o de menor energia e concentra a densidade da carga na região entre os núcleos. • O Orbital Molecular AntiLigante. É o de maior energia que exclui os elétrons da região entre os núcleos. Existem fundamentalmente três tipos de OM: os OM ligantes, que retêm os elétrons de ligação, e portanto são aqueles de menor energia. Os OM's não ligantes podem carregar elétrons extras pertencentes a átomos da molécula mas não envolvidos em ligações, um claro exemplo sendo os seis elétrons restantes do cloro como na molécula de HCl gasoso. Esses são orbitais de energia intermediária. Finalmente, os orbitais antiligantes que não contribuem em nada para uma ligação química, sendo de energia bem mais alta que os outros dois tipos de OM. Ordem de ligação • Na teoria do orbital molecular a estabilidade de uma ligação covalente está relacionada com sua ordem de ligação, como definida a seguir: ordem de ligação = ½ (número de elétrons ligantes – número de elétrons antiligantes) Referências bibliográficas • Química: a ciência central. Brown, LeMay, Bursten. • www.wikipédia.com • www.prenhall.com/brown_br • http://inorgan221.iq.unesp.br/quimgeral/misterios/misterios.html • www.google.com
Download