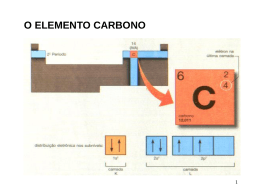
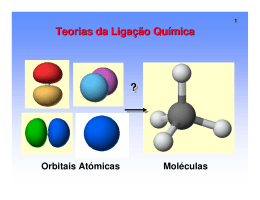
Orbitais Atômicos. Espacialmente, os orbitais s e p apresentam o seguinte aspecto: A Ligação Covalente Hoje. Por volta de 1960, Linus Pauling propôs um novo modelo, explicando a ligação covalente pelo entrosamento de orbitais atômicos incompletos, ou seja, que possuem somente um elétron. Para entendermos esse modelo vamos começar estudando a molécula de H2. Para ocorrer a formação da molécula de H2, é necessário haver ligação entre dois átomos de hidrogênio pela interpenetração dos orbitais incompletos em que os elétrons apresentem spins opostos. Após a interpenetração dos orbitais atômicos, estes se deformam, originando um orbital molecular. Pelas ligações, pode-se perceber que a interpenetração dos orbitais ocorreu ao longo do mesmo eixo; por isso, essa ligação é denominada ligação sigma (σ). Nesse caso é uma ligação que envolveu orbitais do tipo s, denominada σs-s. Ligações Sigma (σ). Conhecendo-se a camada de valência de um elemento, podemos prever a quantidade de ligações covalentes e o tipo de orbitais envolvidos nessas ligações, ou seja, os tipos de ligação sigma. O quadro ao lado mostra alguns tipos de ligação sigma. Ligações pi (π) Quando entre dois átomos ocorrer mais de uma ligação, a primeira será sempre uma ligação sigma e as demais corresponderão a ligações pi, envolvendo os orbitais p contidos em eixos paralelos. Após a interpenetração, os orbitais se deformam, originando os orbitais moleculares pi. A ligação pi é sempre formada pela interpenetração de orbitais incompletos do tipo p, contidos em eixos paralelos. Sua representação será sempre πp-p. Veja dois exemplos: Hibridação de Orbitais Atômicos As ligações covalentes são realizadas por orbitais semi preenchidos (incompletos). Como explicar as quatro ligações do carbono se ele tem apenas dois orbitais semi preenchidos? Hibridação do Carbono. sp3 sp2 sp 1) Os carbonos numerados na estrutura representada a seguir, apresentam, respectivamente as seguintes hibridizações: 3) Para os compostos relacionados abaixo, determine o tipo de ligação covalente e a hibridização de cada carbono numerado. (Exemplo: σ (sp3-sp3)) CH3 1 CH2 2 CH CH2 3 C CH2 4 CH CH 5 C CH CH3 2) A muscalura é um feromônio utilizado pela mosca doméstica para atrair machos, marcar trilhas e outras atividades: a) Qual o número total de ligações sigma neste composto? b) Quais são os tipos de hibridização do carbono presentes no composto? 4)Observe os compostos orgânicos a seguir: Podemos afirmar corretamente que: 01) o composto a apresenta dez ligações sigma e três ligações pi. 02) o composto b apresenta duas ligações pi e seis ligações sigma. 04) o composto c apresenta três ligações pi e duas ligações sigma. 08) no composto e os átomos de carbono apresentam hidridização sp3. 16) no composto d os átomos de carbono I, II, III e IV apresentam respectivamente hibridização sp3, sp2, sp e sp3.
Download