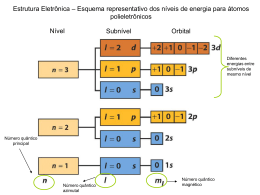
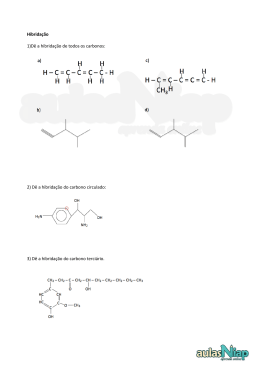
Revisão 1º Bimestre Teorias Atômicas John Dalton Idéia: “O átomo é uma esfera rígida e indivisível.” John Joseph Thomson Idéia: “O átomo é formado por uma esfera de carga elétrica positiva, possuindo, em sua superfície elétrons incrustados.” Ernest Rutherford Idéia: “O átomo possui um núcleo dotado de carga positiva, onde estão os prótons, e ao seu redor estão os elétrons, muito mais leves.” Niels Bohr Modelo que complementa o de Rutherford : “Nos átomos, os elétrons movimentam-se ao redor do núcleo em níveis energéticos." ISOÁTOMOS Isótopos: mesmo número atômico Ex.: 12 6C e 6C14 Isóbaros: mesmo número de massa Ex.: 20Ca40 e 18Ar40 Isótonos: mesmo número de nêutrons Ex.: 6C12 e 5B11 Isoeletrônicos: mesmo número de elétrons Ex.: cátion monovalente do 11Na23 cátion trivalente do 27 13Al Diagrama de Linus Pauling Números Quânticos n=1 n=2 n=3 n=4 n=5 n=6 n=7 Principal (n): indica o nível de energia do elétron ↔ ↔ ↔ ↔ ↔ ↔ ↔ camada K camada L camada M camada N camada O camada P camada Q Números Quânticos Secundário (l): indica o subnível de energia l=0↔ subnível s l=1↔ subnível p l=2↔ subnível d l=3↔ subnível f Números Quânticos Magnético (ml): indica a orientação dos orbitais no espaço. Subnível Valores de l Valores de ml Quantidade de orbitais s 0 0 1 p 1 -1,0,+1 3 d 2 -2,-1,0,+1,+2 5 f 3 -3,-2,-1,0,+1,+2,+3 7 Números Quânticos Spin (ms): indica os sentidos de rotação do elétron. ms = -1/2 ms = +1/2 Propriedades Periódicas Ligações Químicas • Ligação iônica: metal x ametal ocorre transferência de elétrons ∆E ≥ 1,7 Ligações Químicas • Ligação covalente: ametal x ametal ou H x ametal ocorre compartilhamento de elétrons ∆E = 0 ( apolar) e 0 < ∆E < 1,7 (polar) Forças Intermoleculares Forças de Van der Waals: moléculas apolares Dipolo – Dipolo: moléculas polares Ligação de hidrogênio: H com F, O e N Solubilidade x Polaridade • “ Semelhante dissolve semelhante.” • Compostos polares: metanol, álcool etílico, acetona e éter etílico. • Compostos apolares: derivados do petróleo, óleos e gorduras. • Soluto e solvente com polaridades contrárias não há solubilização. Hibridação do Carbono Hibridação do Carbono Hibridação do Carbono Carbono que realiza: 4 ligações σ sp3 3 ligações σ e 1 ligação π sp2 2 ligações σ e 2 ligação π sp
Download