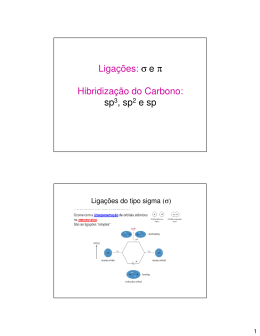
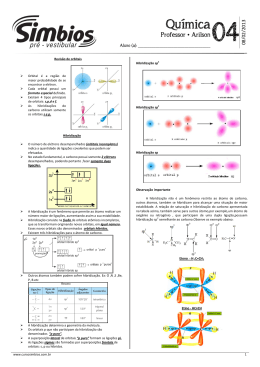
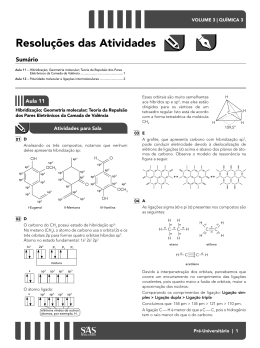
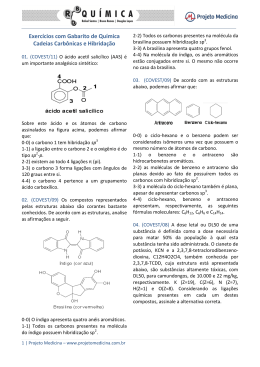
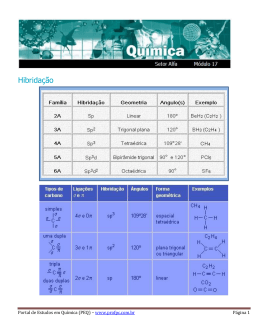
Química Orgânica HIBRIDIZAÇÃO DO CARBONO Vamos Relembrar.... Orbitais Atômicos → “casinha” do elétrons Existem 4 orbitais atômicos s→ d→ f p→ Ligações sigma (σ) e ligações pi (π) Ligações do tipo sigma(σ) Ocorre com a interpenetração de orbitais atômicos no mesmo eixo. São as ligações “simples” Orbital atômico tipo s Orbital molecular (s-s) Ligações sigma (σ) e ligações pi (π) Ligações do tipo pi(π) Ocorre quando os orbitais atômicos se interpenetram em eixos paralelos São as ligações duplas ou triplas O orbital p é o único que apresenta condições para efetuar a ligação pi. A ligação pi é mais fraca que a ligação sigma. As ligações simples são ligações do tipo sigma As ligações dupla e tripla, uma ligação é sigma o resto é pi σ Ligação simples → sempre σ σ σ σ σ Ligação dupla → uma ligação σ e uma ligação π π σ Ligação tripla → uma ligação σ e duas ligações π π π Carbono Número atômico 6 6C12 Distribuição eletrônica 1s2 2s2 2p2 Na camada de Valência Nova configuração Hibridização do Carbono Hibridação ação que produz um híbrido pelo cruzamento de duas espécies diferentes. Ligações Pi (π) Essas ligações são geradas apenas pelo orbital atômico P 3 sp Somente ligações simples s + 3p 4 sp3 Exemplo – metano (CH4) Ligações sigma (σ) Ligações s-sp3 Hibridização do Carbono sp2 uma ligação σ e uma ligação π s + 2p Exemplo – eteno (CH2CH2) 3 sp2 + p = “puro” Ligações C – C sp2 – sp2 σ π Ligações C – H sp2 – s Hibridização do Carbono sp uma ligação σ e duas ligação π s + p 2 sp + 2p = “puro” Ligações C – C sp – sp Exemplo – etino (CH-CH) Ligações C – H sp – s Exercícios (UFSC – 2006) - A asparagina ou ácido aspartâmico (fórmula abaixo) é um aminoácido não essencial que apresenta isomeria óptica. OH N H2 O N H2 O A respeito deste composto, assinale a(s) proposição(ões) CORRETA(S). V 1. O número de oxidação do átomo de carbono do grupo funcional amida é +3. F 02. Possui os seguintes grupos funcionais: álcool e cetona. V 04. Sua fórmula molecular é C4H8N2O3. V 08. A molécula possui dois átomos de carbono com hibridização sp2 e dois com hibridização sp3. F16. Apresenta dois carbonos quirais. GABARITO 13 Exercícios (UDESC 2007/1) O composto α-farneseno é uma das substâncias encontradas no óleo de citronela, e tem a seguinte estrutura: Com relação a essa estrutura, pode-se afirmar que nela: I – Estão presentes 14 ligações sigma (σ) e 4 ligações pi (π). F II – Dos carbonos presentes, 7 possuem hibridização sp3 e 8 possuem hibridização sp2. V III – A geometria dos carbonos com hibridização sp3 é tetraédrica e a dos carbonos com hibridização sp2 é trigonal plana. V IV – Não existe nenhum carbono hibridizado em sp. V Assinale a alternativa correta. a) Somente as afirmativas I, II, III e IV são verdadeiras. b) Somente as afirmativas I, III e IV são verdadeiras. c) Somente as afirmativas I e II são verdadeiras. d) Somente as afirmativas III e IV são verdadeiras. e) Somente as afirmativas II, III e IV são verdadeiras. GABARITO E (UDESC 2007/1 – Enfermagem) Muitos defeitos de nascença, freqüentemente mortais, como a espinha bífida (raquisquise) e a anencefalia (falha no desenvolvimento do normal do cérebro) estão associados à deficiência de ácido fólico nos estágios iniciais da gravidez. Para suprir essas deficiências, os médicos recomendam que todas as mulheres em idade de engravidar façam a ingestão diária de 0,4 mg de ácido fólico. A estrutura do ácido fólico é: a) Qual a fórmula molecular do ácido fólico? b) Quais as funções orgânicas presentes no ácido fólico? c) Quantos carbonos apresentam hibridização sp3? d) Quantos carbonos apresentam hibridização sp2? RESPOSTAS a) C18H15N7O5 b) Amina – Cetona – Ácido Carboxílico c) 3 carbonos possuem hibridização sp3 d) 15 carbonos possuem hibridização sp2 Exercícios (UFSC 2003) - A estrutura do hidrocarboneto aromático benzeno (C6H6) é representada pelo híbrido de ressonância a seguir, que possui: lembrar F 01. três carbonos híbridos em sp3 e três carbonos híbridos em sp2. V 02. seis orbitais não-híbridos denominados “p puro”. V 04. todos os átomos de hidrogênio ligados aos de carbono através de ligações sigma (s-sp2). V 08. três ligações do tipo π. F 16. apenas seis ligações do tipo sigma. F 32. três carbonos saturados e três carbonos insaturados. V 64. todos os carbonos híbridos em sp2. GABARITO 78 UFSC 2007 - O benzeno, descoberto por Faraday em 1825, é a substância fundamental da química dos aromáticos. É utilizado como ponto de partida na síntese de diversas substâncias: De acordo com as informações fornecidas acima, assinale a(s) proposição(ões) CORRETA(S). F 01. O benzeno possui três (3) elétrons pi (π). F 02. O ciclo-hexano pode ser obtido por oxidação do benzeno. V 04. A reação de mononitração do benzeno, seguida de redução catalítica do grupo nitro, produz a anilina. V 08. O tolueno pode ser obtido a partir do benzeno, por alquilação de Friedel Crafts. F 16. A reação de sulfonação do benzeno, seguida de fusão alcalina do ácido benzenossulfônico e acidificação, produz o ciclo-hexano. V 32. A reação do tolueno com permanganato de potássio, em meio ácido, produz o ácido benzóico. GABARITO 44 UFSC 2005 - Na Tabela a seguir encontram-se informações a respeito de três substâncias, que possuem a fórmula molecular C3H8O. SUBSTÂNCIA Característica A Apresenta o menor ponto de ebulição B Por oxidação total produz ácido propanóico C Após oxidação produz propanona Assinale a(s) proposição(ões) CORRETA(S). V 01. A é isômero funcional de B. F 02. Os compostos B e C apresentam carbono assimétrico. F 04. A substância A denomina-se etoxietano. F 08. As substâncias A, B e C possuem pelo menos um átomo de carbono com hibridização sp2. V 16. B e C são isômeros de posição. V 32. O nome IUPAC da substância B é 1-propanol. GABARITO 49 Exercícios (UDESC) O ácido hidróxi-etanóico, também conhecido por ácido glicólico, é bastante utilizado atualmente em cosméticos. Sobre essa molécula é CORRETO afirmar que sua cadeia carbônica apresenta: F a) insaturação; F b) hetoroátomo; V c) um carbono com orbitais híbridos sp2 e outro com orbitais híbridos sp3; F d) carbono assimétrico; F e) carbono secundário; GABARITO - C
Download