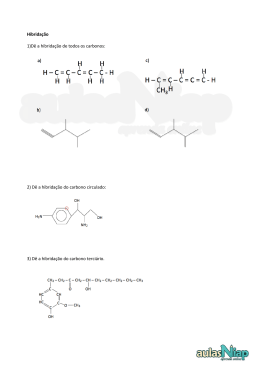
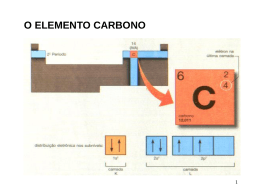
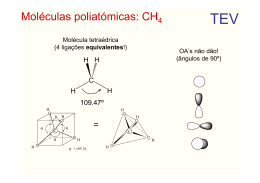
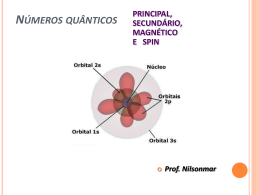
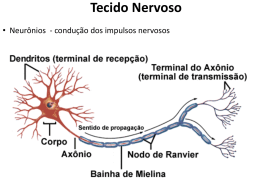
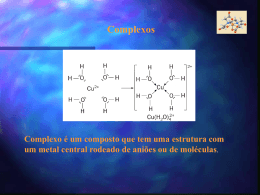
Introdução a Química Orgânica AULA 1 – Evolução da Química Orgânica Bergmam (1777) - Dividiu a química Compostos orgânicos: substâncias dos organismos vivos Compostos inorgânicos: substâncias do reino mineral. Evoluçaõ da Química Orgânica Berzelius início do século XIX Teoria da Força Vital Força maior para serem sintetizados Evolução da Química Orgânica Reação de Friedrich Wöhler (1828): NH2 NH4CNO Cianato de amônio O=C Uréia NH2 Obs. A síntese da uréia definiu a queda da teoria da força vital e o início da química orgânica moderna. Evolução da Química Orgânica Percebeu-se então que a definição Bergman não era adequada e... Evolução da Química Orgânica Kekulé 1858- Definiu que a Química orgânica é a parte da Química que estuda todos os compostos do elemento carbono. Evolução da Química Orgânica E a Química Inorgânica estuda os demais compostos e alguns poucos compostos do elemento carbono denominados : COMPOSTOS DE TRANSIÇÃO Evolução da Química Orgânica Elementos organógenos C,H,OeN Eventualmente estes : S , P e os halogênios : Cl , Br, I e as vezes o F. * Características Gerais Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica. Isomeria: compostos com a mesma fórmula molecular. Solubilidade: os apolares pouco solúveis em água,os polares solúveis, a exemplo do álcool e açúcar. Combustibilidade: em geral são combustíveis. Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas. Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.). Características Gerais Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promovem uma certa polaridade na molécula. Postulados de Couper - Kekulé 1º Postulado: O carbono é tetravalente C ( Z=6) K=2 L=4 Postulados de Couper-Kekulé 2º Postulado As 4 valências do átomo de carbono são iguais entre sí Cl - H H H Cl H - C - H H - C - Cl H -C -H H Cl H H C -H Postulados de Couper-Kekulé 3º Postulado Os átomos de Carbono ligam-se entre sí formando cadeias C-C-C-C-C-C-C Tipos de carbono 1o : l igado diretamente, no máximo, a 1 outro C 2o : l igado diretamente a 2 outros carbonos 3o : l igado diretamente a 3 outros carbonos 4o : l igado diretamente a 4 outros carbonos Tipos de Carbono H H CH3 H H CH3 H H- C - C - C - C - C - C - C -H H H CH3 H H H H Exercício O ELEMENTO CARBONO 17 Hibridização de orbitais atômicos • É a mistura de orbitais pertencentes a um mesmo átomo, originando novos orbitais iguais entre si, mas diferentes dos orbitais originais. • A diferença destes novos orbitais atômicos, denominados orbitais híbridos, acontece tanto na geometria(forma) como no conteúdo energético. • O número dos orbitais híbridos obtidos será o mesmo dos orbitais existentes antes de serem misturados. 18 Hibridização sp3 • É a mistura de 3 orbitais p “puros” com um orbital s “puro”, formando 4 novos orbitais “híbridos” denominados sp3. • A geometria dos 4 orbitais sp3 é tetraédrica (os 4 orbitais partem do centro do tetraédro e dirigemse, cada um, para um dos vértices do tetraédro). • O ângulo entre os orbitais sp3 será de aprox.109° • Acontece no C que se liga através de 4 ligações simples ( o C é tetravalente). 19 2p hibridação 2s sp3 20 Fórmula molecular do metano: CH4 H Fórmula estrutural do metano: H C H H Lembrando, 4 ligações simples sp3 ( 4 orbitais híbridos). Hidrogênio possui 1s orbital não hibridizado. 21 FORMA DAS MOLÉCULAS sp3 - tetraédrica H C N H H H sp3 H H O H H sp3 H sp3 22 Hibridização sp2 • É a mistura de um orbital s com dois orbitais p (pertencentes a um mesmo átomo), resultando em 3 novos orbitais denominados híbridos sp2. • Os três orbitais híbridos sp2 situam-se num mesmo plano formando ângulos de 120° entre si (geometria plana triangular). • Acontece com C que possua uma dupla ligação. • Num C do tipo sp2 existirá um orbital p “puro” que será responsável pela ligação covalente do tipo pi. 23 HIBRIDIZAÇÃO DO CARBONO sp2 Etileno H H C C H H Cada carbono é hibrido sp2 . O hidrogênio é 1s. Uma ligação da dupla é sp2 - sp2. A outra é p - p. 2p 2p hibridação 2s sp2 24 C C Observe que a dupla ligação consiste numa ligação do tipo s e outra do tipo p. 25 H H C C H H H H C H C H 26 Exemplo de hibridação sp2 H2C=CH2 • Molécula de eteno (etileno). • Os dois átomos de C encontram-se ligados por uma dupla ligação Uma ligação sigma sp2-sp2 e uma ligação pi). • Cada átomo de C encontra-se ligado a dois átomos de H (duas ligações sigma s-sp2). 27 A Molécula de C2H4 28 Os ângulos de ligações no C2H4 • Como os átomos centrais são dois carbonos de hibridação sp2 o ângulo entre as ligações sigma será de 120. observe que a ligação p é perpendicular ao plano que contém a molécula. • C com uma dupla ligação hibridação sp2 Numa dupla ligação uma ligação s e uma ligação p 29 HIBRIDIZAÇÃO sp2 sp2 - trigonal planar p ligação H H C H H C H C H eteno (etileno) H H C 120° C H H H C H sligação 30 31 OUTRAS MOLÉCULAS PLANAS TRIGONAIS hibridação sp2 geometria trigonal planar H H C O H H H C N H H H H H H neste exemplo, cada carbono é sp2 32 Hibridação sp • É a mistura de um orbital s com 1 orbital p, produzindo dois novos orbitais denominados híbridos sp. • Os orbitais híbridos sp formam um ângulo de 180 entre si. • A geometria molecular será linear. • Surge em C com duas duplas ou C com uma tripla ligação. • Numa tripla ligação ter-se-á uma ligação sigma e duas pi. 33 Exemplo de hibridação sp C2H2 • Etino (acetileno) • Em torno dos átomos de C existem dois orbitais híbridos sp e dois orbitais p “puros”. • Os dois orbitais híbridos se ligarão através de ligações sigma s-sp (H-C) e sigma sp-sp(C-C). • Os dois orbitais p de cada carbono se ligarão produzindo duas ligações pi entre os carbonos (resultando numa tripla ligação entre os dois carbonos). • Liga tripla uma ligação s e duas ligações p 34 Fórmula estrutural do acetileno H C C H Cada átomo de carbono é um híbrido sp. Os hidrogênios possuem orbitais 1s, não hibridizados. 2p 2p hibridação sp 2s Observe que a tripla ligação consiste de uma s e 2p . As duas ligações pprovem dos orbitais p, não hibridizados. 35 A Molécula de C2H2 36
Download