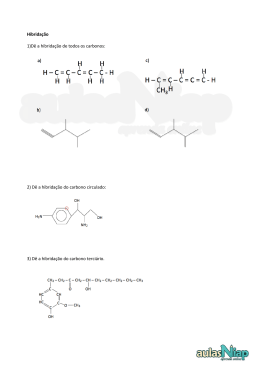
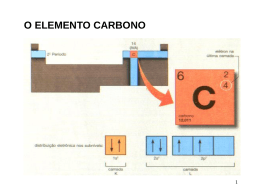
Aula 2.1 Conteúdo • Teoria da repulsão dos pares eletrônicos; • Tipos de ligações. Habilidades : • Entender a importância dos orbitais híbridos e suas implicações na geometria das moléculas orgânicas. 1 Principais Características do Átomo de Carbono Para você, isto é um boneco de palitos... ...para nós isto é 1-ciclopentil-bis-2,6-(2,2-dimetil) Propil-3,5-ciclopropilmetil-ciclohexano 2 ANIMAÇÃO 3 Hibridização Hibridar ou hibridizar significa alterar a forma dos orbitais 2s, 2px, 2py e 2pz. 4 Hibridização 1º tipo: Hibridação tetraédrica ou sp3 Orbital Atômico 5 Hibridização A configuração espacial do carbono híbrido em sp3 é tetraédrica Número de orbitais híbridos = 4 Ângulo entre os orbitais híbridos = 109° 28´ C ᵨ ᵨ ᵨ ᵨ Trata-se de carbono "saturado” (ligações sigma). 6 Hibridização 2. Hibridação trigonal plana ou sp2 Orbital Atômico 7 Hibridização 8 ᵨ Cπ ᵨ ᵨ A configuração espacial do carbono híbrido em sp2 é trigonal plana (figura). Ângulo ente os orbitais híbridos = 120°. Trata-se de carbono "insaturado" com uma dupla ligação e duas ligações simples (três ligações do tipo sigma e uma do tipo pi). Hibridização 3º tipo: Hibridação linear plana ou sp. Orbital Atômico 9 Hibridização 10 C π π ᵨ ᵨ ᵨ C π π ᵨ A configuração espacial do carbono híbrido em sp é linear plana (figura). Ângulo entre os orbitais híbridos = 180°. Trata-se de carbono "insaturado" com duas duplas ligações ou com uma tripla e uma simples ligações (duas ligações do tipo sigma e duas do tipo pi). Desafio Químico no Chat 1. (OSEC) As hibridações de orbitais sp, sp2 e sp3 possuem, respectivamente, os seguintes ângulos: a) 120°, 109°, 180° b) 120°, 180°, 109° c) 109°, 180°, 120° d) 180°, 120°, 109° e) 180°, 109°, 120° 11 Dinâmica Local Interativa 1. O Estradiol, um hormônio esteroide de fundamental importância no desenvolvimento dos caracteres sexuais femininos e na própria fisiologia da reprodução, possui a seguinte fórmula estrutural: CH 3 OH HO Com referência a esse composto, encontre as hibridações sp2 na figura. 12 Dinâmica Local Interativa 2. Observe os compostos abaixo e marque a alternativa correta: H H H H H C C H C C H H H H (II) (I) 13 H C C C H (III) H H Dinâmica Local Interativa a) o composto III apresenta seis ligações sigma e duas pi; b) o composto II apresenta duas ligações pi e seis ligações sigma; c) o composto I apresenta dez ligações sigma e três ligações pi; d) no composto I, os átomos de Carbono apresentam hibridização tipo sp2; e) no composto III, os átomos de Carbono apresentam hibridização tipo sp3. 14
Download