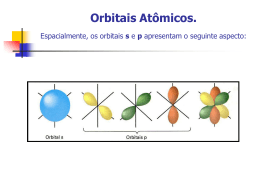
www.quimica10.com.br AULA 09: TEORIA DOS ORBITAIS - HIBRIDIZAÇÃO DO CARBONO I - TEORIA DOS ORBITAIS. Na aula anterior verificamos as ligações químicas através da regra do Octeto desenvolvida por Lewis. Nesta aula apresentaremos o modelo de ligação química apartir de orbitais moleculares. De acordo com a teoria dos orbitais moleculares, as ligações químicas (pareamento eletrônico) só são efetuadas por orbitais atômicos semipreenchidos ou incompletos, estes se interpenetram originado orbitais moleculares conhecidos como orbitais moleculares sigma (σ) e orbitais moleculares pi (π) Os orbitais atômicos de interesse são tipo s (esférico) e tipo p (halteres – orientado nos eixos ortogonais). LIGAÇÃO σ : é a ligação formada pela interpenetração frontal de orbitais (segundo um mesmo eixo). A ligação s é forte e difícil de ser rompida. Pode ser feita com qualquer tipo de orbital atômico; Observe a ligação entre orbitais de hidrogênio para constituir uma molécula de H2 Esses orbitais se atraem mutuamente até que se interpenetram formando um orbital tipo Sigma (s-s). Analise agora uma interpenetração de orbital s e p formando uma ligação sigma. www.quimica10.com.br LIGAÇÃO π : é a ligação formada pela aproximação lateral de orbitais (segundo eixos paralelos). A ligação p é mais fraca e mais fácil de ser rompida; Só ocorre entre orbitais atômicos do tipo "p". Observe a figura Com o exposto pode-se concluir que simples ligações são efetuadas através de orbitais moleculares tipo σ, as duplas ligações são desenvolvidas por orbital tipo σ e π, já as triplas ligações são formadas por 1 orbital tipo σ e dois tipo π. II - HIBRIDAÇÃO A teoria da hibridização, tenta justificar as ligações químicas à nível de orbitais que não podem ser justificadas pela Regra do Octeto. As hibridizações estudadas no Ensino Médio, são do tipo sp3, sp2 e sp, evidenciadas para o carbono, boro e berílio. Como vimos anteriormente, só constitui ligação química o orbital semipreenchido, sendo assim o elemento carbono que apresenta apenas dois orbitais semipreenchidos, executaria apenas duas ligações químicas ao invés de quatro ligações como cotidianamente efetua. Através da teoria dos híbridos justiçamos essas ligações. www.quimica10.com.br Para o carbono temos: 6 C – 1s2 2s2 2p2 configuração no estado fundamental. A teoria de hibridização, admite que o elétron s2 absorva alguma forma de energia e seja promovido para o orbital p vazio, caracterizando assim o estado excitado ou ativado. Através do número de ligações pi efetuadas pelo carbono teremos a fusão de orbitais s e p para formar os estados híbridos que definem as ligações tipo sigma. Sendo assim teremos: Carbono com 2 ligações pi e 2 sigmas (carbono com uma ligação tripla ou duas duplas) - C ≡ ou =C= hibridização tipo sp www.quimica10.com.br Carbono com 1 ligação pi e três ligações sigma. (carbono com uma dupla ligação) Hibridização sp2 Carbono com quatro ligações tipo sigma. (carbono com apenas simples ligações) Hibridização sp3 www.quimica10.com.br O quadro a seguir trás de maneira resumida as hibridizações de interesse ao Ensino Médio, assim como o ângulo existente entre os ligantes e a geometria adotada pela molécula hibridizada. Família Hibridação Geometria Angulo(s) Exemplo 2A Sp Linear 180° BeH2 (C2H2*) 3A Sp2 Trigonal plana 120° BH3 (C2H4*) 4A Sp3 Tetraédrica 109°28' CH4* Importante. Carbono: (CH4*) = 4 ligações simples: sp3; (C2H4*) = 01 dupla e 02 simples: sp 2; (C2H2*) = 02 duplas ou 01 tripla e 01 simples: sp) Obs.: Hibridação da amônia (NH3) e da água (H2O): sp3. PROPOSIÇÃO DE ATIVIDADES. 01. (UFF) As ligações químicas nos compostos orgânicos podem ser do tipo sigma ou pi. A ligação σ é formada pela interação de dois orbitais atômicos, segundo o eixo que une os dois átomos, ao passo que na ligação π, a interação dos orbitais atômicos se faz segundo o plano que contém o eixo da ligação. www.quimica10.com.br Na estrutura representada acima, tem-se: a) 2 ligações σ e 6 ligações π b) 2 ligações σ e 8 ligações π c) 4 ligações σ e 4 ligações π d) 6 ligações σ e 2 ligações π e) 8 ligações σ e 2 ligações π Resultado: letra E 02. (UFRN) Na molécula de propeno (CH2 = CH – CH3), qualquer um dos carbonos com hibridização sp2 apresenta: a) 1 ligação sigma e 3 ligações pi b) 4 ligações sigma e 2 pi c) 2 ligações sigma e 2 pi d) 3 ligações sigma e 1 ligação pi Resposta: letra D 03. (Puc-rio) Tal como o CO2, o CH4 também causa o efeito estufa, absorvendo parte da radiação infravermelha que seria refletida da Terra para o espaço. Esta absorção deve-se à estrutura das suas moléculas que, no caso destes dois compostos, apresentam, respectivamente, ligações: www.quimica10.com.br Números atômicos: H = 1; C = 6; O = 8 a) π e σ s. b) π e σ s-sp3. c) π e σs-p. d) σs e π. e) σs-sp3 e π. Resultado: letra B 04. (Puc-PR) A acetona (H3C-CO-CH3), um importante solvente orgânico, apresenta nos seus carbonos, respectivamente, os seguintes tipos de hibridação: a) sp, sp2 e sp3 b) sp3, sp3 e sp3 c) sp2, sp e sp3 d) sp3, sp2 e sp3 e) sp3, sp2 e sp2 Resultado: letra D 05. (UERJ) O gosto amargo da cerveja é devido à seguinte substância de fórmula estrutural plana: www.quimica10.com.br Essa substância, denominada mirceno, provém das folhas de lúpulo adicionadas durante a fabricação da bebida. O número de ligações pi presentes na estrutura do mirceno é igual a: a) 3 b) 5 c) 8 d) 15 Resultado: letra A 06. (Mackenzie-SP) O BeH2 é uma molécula que apresenta: Dados os números atômicos: Be=4 e H=1 a) geométrica molecular linear. b) ângulo de ligação igual a 120°. c) o átomo de berílio com hidridação sp2. d) uma ligação covalente sigma s-s e uma ligação pi. e) duas ligações covalentes sigma s-p. Resultado: letra A 07. (UERJ) Na composição de corretores do tipo "Liquid Paper", além de hidrocarbonetos e dióxido de titânio, encontra-se a substância isocianato de alila, cuja fórmula estrutural www.quimica10.com.br plana é representada por CH2 = CH – CH2 - N = C = O. Com relação a esta molécula, é correto afirmar que o número de carbonos com hibridação sp2 é igual a: a) 1 b) 2 c) 3 d) 4 Resultado: letra B 08. (UFSC – adaptada) Assinale as proposições CORRETAS. Em relação à figura a seguir (HC ≡ CH), podemos afirmar que: 01. entre os átomos de carbono existem uma ligação σ do tipo sp2-sp2 e uma ligação π do tipo p-p. 02. entre os átomos de carbono existem uma ligação σ do tipo sp-sp e duas ligações π do tipo p-p. 04. a geometria da molécula é linear. 08. a ligação, entre o carbono e hidrogênio, é σ do tipo sp2 -s. Soma das corretas ( Resultado: 02+04 = 06 ) www.quimica10.com.br 09. (Mackenzie-SP) Nos compostos triclorometano (Cl3CH) e trifluoreto de boro (BF3), o carbono e o boro apresentam, respectivamente, hibridação: Dados: Boro (n° atômico=5) e Carbono (n° atômico=6) Cl (7A) e F (7A) a) sp2 e sp3. b) sp3 e sp3. c) sp3 e sp. d) sp e sp2. e) sp3 e sp2. Resultado: letra E 10. A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4) pode(m) ser interpretada(s) como sendo formada(s) pela interpenetração frontal dos orbitais atômicos "s" do átomo de hidrogênio, com os seguintes orbitais atômicos do átomo de carbono: a) Quatro orbitais p. b) Quatro orbitais sp3. c) Um orbital híbrido sp3. d) Um orbital s e três orbitais p. e) Um orbital p e três orbitais sp2. Resultado: letra B 11. (Mackenzie-SP) Na ligação entre átomos do elemento químico cloro, que tem número atômico igual a 17, forma-se uma: a) molécula triatômica. b) substância simples iônica. c) molécula apolar. www.quimica10.com.br d) molécula polar. e) substância composta gasosa. Resultado: letra C 12. (UFSC) Assinale a(s) proposição(ões) CORRETA(S). Os compostos formados a partir dos elementos oxigênio, cloro, sódio e cálcio devem apresentar fórmulas, ligações químicas predominantes e estados físicos, em condições ambientes, respectivamente: 01. CaCl2, iônica, sólido. 02. NaCl, iônica, líquido. 04. Cl2, covalente, gás. 08. Na2O, covalente, líquido. 16. O2, iônica, gás. Resultado: 01 + 04 = 05 13. (Fei-SP) As moléculas do monóxido de carbono (CO) e do dióxido de carbono (CO 2) possuem diferenças nas suas estruturas moleculares. Assinale a alternativa correta: Dados: C (Z = 6) O (Z = 8) a) CO tem ligações iônicas e CO2 ligações covalentes b) CO tem duas ligações covalentes simples e CO2 tem duas ligações covalentes simples e duas dativas. c) ambas possuem duas ligações covalentes dativas d) CO possui duas ligações covalentes simples e uma dativa e CO2 possui quatro ligações covalentes simples e) CO é linear e CO2 é triangular www.quimica10.com.br Resultado: letra D 14. Dada a fórmula estrutural da metilamina, responda: quais os números de elétrons das camadas de valência do nitrogênio e do carbono? H | H-N-C-H | | H H Resultado: 5 e 4
Download