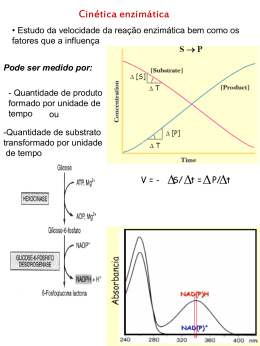
FACULDADE DE MEDICINA DE RIBEIRÃO PRETO BIOQUIMICA GERAL RFM 0004 CINETICA ENZIMATICA Prof. Dr. Vanderlei Rodrigues Departamento de Bioquímica e Imunologia -2014- HISTÓRICO Em 1913, Michaelis e Menten desenvolveram uma equação para examinar a cinética das reações enzimáticas. O modelo pressupõe que o E liga-se ao S formando um complexo ES para em seguida liberar o produto P complexo enzima substrato complexo enzima produto Substrato(S) + Enzima (E) (ES) (EP) componentes livres E+P A proporção de ES formado limita a velocidade da reação: v= velocidade inicial da reação v= kcat (ES) kcat= constante de catalise (ES)= concentração do complexo ES CINÉTICA ENZIMÁTICA Velocidade reação (v) Vmax. Como explicar este comportamento cinético Vo 0 0 concentração do substrato (S) EQUAÇAO DE MICHAELIS-MENTEN k1 S + E k2 ES k-1 E + P k-2 (ES) = (Et) (S) k-1 + k2 + (S) k1 A reação acima, mostra que existe um equilíbrio entre os componentes da reação e que o complexo ES é rapidamente formado. A sua decomposição em E e P é o processo limitante da velocidade. V0 = k2 (ES) Velocidade inicial da reação Vmax = k2 (Et) Velocidade máxima Onde Et = (E) + (ES) Equação de Michaelis-Menten Velocidade Inicial (V0) Velocidade Máxima (Vmax.) V0 = k2 (ES) Nesta situação temos (Et)=(ES) (ES) = (Et) (S) k-1 + k2 + (S) k1 Vmax. = k2 (Et) V0 = k2 (Et) (S) k-1 + k2 + (S) k1 V0 = Vmax. (S) k-1 + k2 k1 + (S) Km (Constante de Michaelis-Menten) V0 = Vmax. (S) Km + (S) EQUAÇÃO DE MICHAELIS-MENTEN CÁLCULO DO Km Velocidade da reação (V) Vmax. Quando Km = (S) teremos V0 = Vmax (S) Km + (S) V0 = Vmax (S) (S) + (S) V0 = Vmax (S) 2 (S) V0 = Vmax 2 V0 Km Concentração do substrato (S) QUAL O SIGNIFICADO DO Km? O Km, indica a afinidade do substrato perla enzima. Quanto maior o valor do Km, maior é afinidade da enzima pelo substrato. Abaixo, temos a cinética de duas enzimas a glicoquinase e a hexoquinase, onde ambas catalisam a mesma reação, a fosforilação da glicose em glicose-6-fosfato A glicoquinase com maior valor de Km para a glicose, fosforila a glicose mais eficientemente. TRANSFORMAÇÃO DA CURVA DE MICHAELIS-MENTEN EM UMA RETA DE LINEWEAVER-BURK E DE EADIE-HOFSTEE PARA O CÁLCULO DO Km E DA Vmax. Aos gráficos mostram a velocidade (V) versus concentração do substrato (S): A. GRÁFICO DE MICHAELIS-MENTEN B. GRÁFICO DE LINEWEAVER-BURK C. GRÁFICO DE EADIE-HOFSTEE INIBIÇÃO ENZIMÁTICA INIBIÇÃO COMPETETIVA: Neste tipo de inibição , o inibidor tem estrutura semelhante ao do substrato e com isto ele dificulta a entrada do substrato no sitio de ligação com a enzima. A INIBIÇÃO COMPETITIVA ALTERA O VALOR DO Km SEM ALTERAR A VELOCIDADE MÁXIMA COMO MOSTRAM OS GRÁFICOS ABAIXO: EXEMPLOS DE INIBIÇÃO COMPETIVA NA PRÁTICA MÉDICA: 1. Tratamento da hipertensão Angiotensinogênio Rim Renina Angiotensina I Angiotensina II Enzima Conversora de Angiotensina (ECA) Inibição pelo Captopril (competitiva) 2. Envenenamento pelo Metanol Metanol Aldeído Fórmico Altamente tóxico (cegueira) álcool desidrogenase Etanol Aldeído Acético Acetato Álcool desidrogenase ˃ afinidade pelo etanol Metabolizado Pressão INIBIÇÃO NÃO COMPETITIVA Neste tipo de inibição, o inibidor liga se na enzima em um sítio diferente de ligação do substrato A inibição não competitiva altera a velocidade máxima A inibição não competitiva não altera o valor do Km EXEMPLO DE INIBIÇÃO NÃO-COMPETITIVA: Um exemplo clássico é o envenenamento por inseticida tipo organofosforado onde o inseticida liga irreversivelmente à enzima acetilcolineesterase. Acetilcolina Colina + Acetato Acetilcolinesterase ↑Acetilcolina X Acetilcolinesterase-organofosforado (inibição não competitiva) Estimulo constante da junção neuromuscular Tratamento: Atropina impede a ligação na junção neuromuscular
Download



![K m +[S]](http://s1.livrozilla.com/store/data/000111072_1-6f369f2e79d26c21993e0f0f04312053-260x520.png)
![+ [E] [S] - Sistemas EEL - Universidade de São Paulo](http://s1.livrozilla.com/store/data/000150897_1-f33431079ef06af434a6636d8f76dc77-260x520.png)