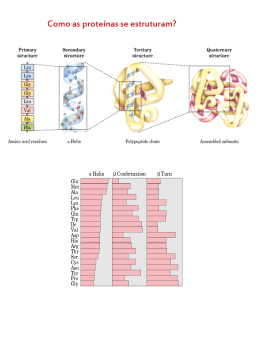
ENZIMOLOGIA
1. ENZIMAS
• CONCEITO
• PODER
“Proteínas” funcionando como catalisadores de
reações bioquímicas
CATALITICO: “Tornam realidade reações
termodinamicamente
possíveis,
velocidade das reações”
acelerando
a
C12 H22O11 + 12O2 12CO2 + 11H2O GO’= -1360 kcal/mol
CO2 + H2O H2CO3 (1:105:seg)
•COENZIMA – Molécula Org.: NAD+; FAD (Grupa/o Prostético)
COFATOR: Íon (Cl-; Fe++; Mg++)
CLASSIFICAÇÃO
1. OXIDOREDUTASES:
Transferência de elétrons
2. TRANSFERASES: Transferência de grupos entre moléculas
3. HIDROLASES: Reações de hidrolise (H2O)
4. LIASES:
Adição de grupos a duplas ligações
5. ISOMERASES: Transferência de grupos dentro da molecula
6. LIGASES:
Formação de ligações químicas (ATP)
D-Glicose + ATP
Glicose-6P + ADP
ATP:GlicoseFosfoTransferase (Hexoquinase – HK)
D-Glicose + ATP (SUBSTRATOS); Glicose-6P + ADP (PRODUTOS)
ESPECIFICIDADE - Hidrolases
• PROTEASE:
Hidrolisa (quebra) Proteínas
• LIPASE: Quebra Lipídios
• NUCLEASE : DNAse; RNAse
GLICOSIDADE ???
PROTEASES
1. PEPSINA :
Proteinas (aa)n
aminoácidos (n x aa)
2. TRIPSINA : Hidrolisa ligações peptidicas aa - Arg ou Lys NH2aa1aa2.......Arg20.......Lys30....aa99aa100COOH
NH2aa1.......Arg20COOH
+ NH2aa21...... Lys30COOH
3. TROMBINA : aa1.................ArgGly...............aan
+
aa31...aa100
ESTEREOESPECIFICIDADE
FUMARATO + NH4
Aspartase
-O-C=O
-O-C=O
3HN-C-H
C-H
H-C
L- ASPARTATO
+ NH4
C-H2
-O-C=O
-O-C=O
MALEATO (Isômero Cis) + NH4
x
x
Aspartase
???
NADA !!!!!!!!
Aspartase
D- Aspartato
NADA !!!!!!!!!
CATALISADORES BIOLÓGICOS
A + B
P
“Moléculas para reagirem necessitam serem elevadas a um
determinado nível de energia, denominado ENERGIA de
ATIVAÇÃO”
• CALOR
• CATALISADOR
Aumento de Energia Cinética
Direcionando os Choques
E
N
E
Não
Enzimática
R
G
I
Enzimática
A
Progresso da Reação
SÍTIO ATIVO
• POSICIONAMENTO
• CATALÍTICO
ENCAIXAR o SUBSTRATO
ONDE OCORRE a REAÇÃO
CARACTERÍSTICAS
• FENDAS ou SULCOS
• PEQUENA PORÇÃO
TRIDIMENSIONAL
Lisozima: aa 35, 52, 62, 63 e 101
• ESPECIFICIDADE
• LIGAÇÕES FRACAS
3 a 12 kcal/mol
ESPECIFICIDADE
S
Ligação a ser Atacada
Grupo de Ligação
E
Sítio Catalítico
Sítio de Posicionamento
LISE
R
CH
C
X
Posicionamento
(P)
O
Catalítico
(C)
QUIMIOTRIPSINA
SÍTIO ATIVO = P + C
Pequena Porção
Tridimensional
(Lisozima)
Especificidade
Ligações Fracas (312 Kcal / mol)
Fendas ou Sulcos
ESPECIFICIDADE
Hidrólise
NH2
CH2CHC
R
NHCHCOO -
PEPTÍDEO
O
Hidrólise
NH2
CH2CHC
NH2
AMIDA
O
NH2
CH2CHC
O
OCH2
ÉSTER
CINÉTICA ENZIMÁTICA
E + S
[ES]
• CONCENTRAÇÃO da ENZIMA
v
P + E
• ...... Do SUBSTRATO
Vmax [S]
VMAX
v =
Zero
Km + [S]
Mista
Km
1a Ordem
[S]
Km
Afinidade ES
EFEITO CHAVE-FECHADURA?
FACTORES que AFETAM a ATIVIDADE
ENZIMÁTICA
v
v
Pepsina = 1,5
Tripsina = 7,7
Desnaturação
Térmica
Calor
Arginase = 9,7
0C
pH
ótimo
t Ótima
INIBIÇÃO REVERSÍVEL COMPETITIVA
INIBIÇÃO ENZIMÁTICA
REVERSÍVEL
COMPETITIVA
Inibição é revertida pelo aumento de
concentração do {S}
COMPETIÇÃO PELO SÍTIO ATIVO
INIBIÇÃO ENZIMÁTICA
REVERSÍVEL
O-
O
C
O
COMPETITIVA
O
-
O
CH2
CH2
CH2
C
C
[S]
O
O-
O
C
C
-
OSDH
CH
FADH 2
O
2H+
C
FAD
O-
[I]
CH
O
INIBIÇÃO ENZIMÁTICA
REVERSÍVEL
COMPETITIVA
1 / V0
Com Inibidor
Sem Inibidor
1 / VMAX
- 1 Km
1 / [S]
APLICAÇÃO DE INIBIÇÃO COMPETITIVA
TRATAMENTO DE GÔTA
OH
C
N
C
N
CH
HC
XANTINA
C
N
URATO
OH
N
ALOPURINOL
C
N
C
HC
C
N
CH
N
N
APLICAÇÃO DE INIBIÇÃO COMPETITIVA
ETANOL COMO AGENTE TERAPÊUTICO:
TRATAMENTO DO ENVENENAMENTO POR ETILENOGLICOL E METANOL
OH H
CH2 OH Desidrogenase
C
Alcoólica
CH2 OH
CH2 OH
CH2 OH
CH3
OH
O
C
C
OH
O
INIBIÇÃO REVERSÍVEL não-COMPETITIVA
INIBIÇÃO REVERSÍVEL - Mista
INIBIÇÃO IRREVERSIVEL
INIBIÇÃO ENZIMÁTICA
IRREVERSÍVEL
CH3
H 3C - C - O
O
HC 3 - C - O - CH 2 - N - CH 3
O
+
CH3
CH3
HO -CH2 -CH 2 -N-CH 3
CH3
CH 2
OH
+
DFP
Enzima Ativa
Serina
CH 2
O
DFP
Enzima Inativa
ENZIMAS ALOSTÉRICAS
REGULAÇÃO por MODIFICAÇÃO COVALENTE
INIBIÇÃO pelo PRODUTO
FINAL
INIBIÇÃO ENZIMÁTICA
REVERSÍVEL
NÃO COMPETITIVA
O INIBIDOR SE LIGA NO SÍTIO ALOSTÉRICO
Download