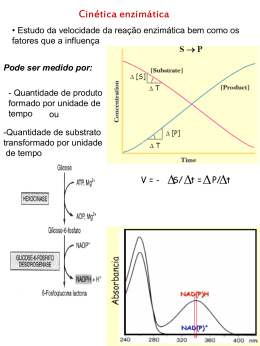
1 Degustação de trechos de livros sugeridos Enzimas Fonte: Wilson & Walker. Principles and Techniques of Biochemistry and Molecular Biology, 7ed. Página 581Quando uma enzima é misturada com um excesso de substrato há um período de tempo inicial curto (algumas centenas de microsegundos) em que os intermediários levando a formação do produto aumentam gradativamente (Figura 15.1 pág 585 do livro). Esta etapa chamada de estado pré-estacionário requer técnicas especiais para o estudo os quais serão discutidos na Seção 15.3.3. Após o estado pré-estacionário, a velocidade da reação e a concentração dos intermediários alteram-se relativamente de forma lenta com o tempo constituindo a chamada cinética do estado estacionário. Medidas do progresso da reação durante esta fase resultam na relação mostrada na Figura 15.2. As tangentes desenhadas a partir da origem das curvas de concentração de substrato (S) e de produto (P) versus o tempo permitem calcular a velocidade inicial (o). Esta é a velocidade máxima para uma determinada concentração de enzima e substrato sob as condições experimentais definidas. Medidas da velocidade inicial de uma reação catalisada enzimaticamente são essenciais para o completo entendimento do mecanismo de ação da enzima, bem como para a estimativa da atividade de uma enzima em uma amostra biológica. Seu valor numérico é influenciado por vários fatores, incluindo concentração de substrato e enzima, pH, temperatura e a presença de ativadores ou inibidores. Para várias enzimas, a velocidade inicial, o, varia hiperbolicamente com a concentração do substrato para uma concentração fixa de enzima (Figura 15.3). A equação matemática que expressa essa relação hiperbólica entre velocidade inicial e a concentração de substrato é conhecida como equação de Michaelis-Menten: o = Vmax[S] Km + [S] Onde Vmax é o valor máximo da velocidade inicial quando todos os sítios ativos estão ocupados, Km é a constante de Michaelis e [S] é a concentração do substrato. Em baixas concentrações do substrato a ocupação dos sítios ativos das enzimas é baixa e a velocidade da reação é diretamente relacionada ao número de sítios ocupados. Isto é, próxima da cinética de primeira-ordem em que a velocidade é proporcional à concentração do substrato. Em concentrações altas do substrato, todos os sítios ativos são ocupados e a reação torna-se independente da concentração do substrato, pois não há como formar mais complexos enzima-substrato (ES), observando-se assim uma cinética de ordem-zero ou de saturação em relação ao substrato. Sob estas condições a velocidade da reação é somente dependente da conversão do complexo enzimasubstrato, ES, em produto (P) e da difusão dos produtos a partir da enzima. Pode ser observado a partir da equação 15.1 que quando o =0.5 Vmax, Km=[S]. Então, Km é numericamente igual à concentração do substrato quando a velocidade inicial é igual à metade da sua velocidade máxima (Figura 15.3) tendo como unidade a molaridade. Valores de Km estão na faixa de 10-2 a 10-5 M e são importantes pois permitem calcular a concentração do substrato necessária para saturar todos os sítios ativos da enzima. Quando a [S]>>Km, a equação 15.1 é reduzida a o Vmax, mas um simples cálculo revela que quando [S] = 10 Vmax, o é somente 90% Vmax e que quando 1 2 [S] = 100 Km, o =99 % Vmax. Apreciações deste tipo são importantes para os ensaios enzimáticos. Como mencionado anteriormente, reações catalisadas enzimaticamente ocorrem por meio da formação de um complexo enzima-substrato em que o substrato (S) liga-se nãocovalentemente ao sítio ativo da enzima (E). A formação deste complexo para a maioria das enzimas é rápido e reversível e é caracterizado por uma constante de dissociação, Ks do complexo: Onde k1 e k-1 são as constantes de velocidade para as reações de formação e dissociação do complexo ES, respectivamente. No equilíbrio, as velocidades de formação e dissociação são iguais e a lei de ação das massas pode ser aplicada para a reação reversível: k1[E][S] = k-1[ES] Portanto, Ks = [E][S] = k-1 = 1 [ES] k1 Ka Onde Ka é a constante de associação (ou afinidade). Pode ser observado que quando o Ks é numericamente grande, o equilíbrio está a favor das formas E e S livres. Por outro lado, quando o Ks é numericamente pequeno, o equilíbrio está a favor da formação do complexo ES. Portanto, Ks é inversamente proporcional à afinidade da enzima pelo substrato. A conversão de ES em produto (P) pode ser representada pela equação: Onde k2 é uma constante de primeira ordem para a reação. Em alguns casos a conversão de ES em E e P pode envolver vários estágios e pode não ser essencialmente irreversível. A constante de velocidade k2 é geralmente menor que k1 e k-1, e em alguns casos muito menor. Em geral, portanto, a conversão e ES em produtos é a etapa limitante tal que a concentração de ES é essencialmente constante, mas não necessariamente a concentração de equilíbrio. Nestas condições a constante de Michaelis, Km, é dada por: Km = k2 + k-1 = Ks + k2 k1 k1 É evidente, que nestas circunstâncias, Km deve ser numericamente maior que Ks e somente quando k2 é muito pequeno o Km se aproxima do valor de Ks. A relação entre 2 3 estas duas constantes torna-se mais complicada pelo fato de que para algumas reações enzimáticas dois produtos (P1 e P2) são gerados sequencialmente, cada um deles controlado por constantes de velocidade diferentes. Portanto, cuidados devem ser tomados na interpretação do significado de Km em relação ao Ks. A relação matemática entre Km e Ks e Km e afinidade da enzima pelo substrato só pode ser apreciada totalmente somente quando o mecanismo completo da reação é conhecido. Embora a equação de Michaelis e Mentem possa ser usada para o cálculo de Vmax e Km, seu uso é sujeito a dificuldades na determinação experimental de o em altas concentrações de substrato, em outras palavras, na extrapolação da curva hiperbólica para obtenção de um valor exato de Vmax. Transformações lineares da equação de Michaelis e Mentem são alternativas comumente utilizadas. O mais popular destes é a equação de Lineweaver-Burk obtida tomando-se o recíproco da equação de Michaelis e Mentem. 1 = Km 1 + 1 o Vmax [S] Vmax O gráfico de 1/o (y) versus 1/[S] (x) resulta em uma reta, onde a inclinação é Km/Vmax, o intercepto no eixo 1/o é igual a 1/Vmax e o intercepto no eixo 1/[S] é igual a -1/Km. Gráficos alternativos são baseados na equação de Hanes e na de Eadie-Hofstee. Também existem softwares de regressão não linear como o DynaFit (www.biokin.com) e BRENDA (www.brenda-enzymes.info), os quais são utilizados preferencialmente em casos onde se requer dados precisos de cinética. É importante notar que enquanto o Km é uma característica da enzima e de seu substrato e o seu valor independente da quantidade da enzima utilizada para a sua determinação experimental, o mesmo não é verdade para o Vmax. Não existe um valor absoluto de Vmax e o seu valor depende da quantidade de enzima usada. Essa característica é ilustrada na Figura 15.3 (página 586) e é adicionalmente discutida no Exemplo 1 (página 589). Além de Km e Vmax, uma outra constante catalítica de importância é kcat, ou número de renovação (turnover number), definido como: kcat = Vmax [Et] Onde [Et] é a concentração total de enzima. O número de renovação é o número máximo de mols de substrato que podem ser convertidos em produto por mol de enzima em uma unidade de tempo. Sua unidade é dada pelo recíproco do tempo em segundos (s1 ). Seus valores variam de 1 a 107 s-1. Catalase possui um número de renovação de 4 107 s-1 e é uma das enzimas mais eficientes conhecidas. O potencial catalítico de um alto valor de número de renovação só pode ser atingido em altas concentrações de substrato (concentrações saturantes) e isso é raramente atingida em condições celulares. Uma constante alternativa, chamada de constante de especificidade, definida como kcat/Km, é uma medida de quão eficientemente uma enzima converte substrato em produto em baixas concentrações de substrato. Sua unidade é dada por M-1s-1. Para um substrato ser convertido em produto, moléculas de substrato e da enzima precisam primeiramente colidir por difusão randômica e então combinar-se e uma orientação correta. Difusão e colisão possuem constantes de velocidades teóricas 3 4 limitantes em torno de 109 M-1s-1 e várias enzimas, incluindo acetilcolina esterase, anidrase carbônica, catalase, -lactamase e triosefosfato isomerase, possuem constantes de especificidade próximas deste valor indicando que elas estão próximas ao máximo de eficiência catalítica. Como a constante de especificidade é uma razão entre duas outras constantes, enzimas com constantes de especificidade similares possuem valores bastante diferentes de Km. Como exemplo, catalase possui constante de especificidade de 4 107 M-1s-1 com um Km de 1.1 M (bastante alto), por outro lado, fumerase possui uma constante de especificidade de 3.6 107 M-1s-1com um Km de 2.5 10-5 M (bem baixo). Complexos multienzimáticos conseguem superar limitações decorrentes de difusão e colisão. Neste caso, o produto de uma reação é passada diretamente por um processo de direcionamento (channelling) para o sítio ativo da próxima enzima na via como consequência da justaposição no complexo, portanto eliminando limitações referentes à difusão. Efeito da concentração do substrato Pode ser observado para reações enzimáticas monosubstrato que eles obedecem a cinética de Michaelis e Mentem: o = k2[E][S] Km + [S] E, portanto, o = k2 [E] (Km/[S]) + 1 Então, quando a concentração do substrato é grande, a equação anterior reduz-se a o = k2 [E] Onde a velocidade é proporcional à concentração do susbstrato. Esta é a base para determinação experimental da atividade enzimática de uma amostra biológica. 4 5 Inibição de reações enzimáticas - Inibição reversível competitiva Inibidores reversíveis combinam-se não covalentemente com as enzimas e, portanto podem ser removidas facilmente por diálise. Inibidores reversíveis competitivos combinam-se no mesmo sítio que o substrato e deve ser, portanto ser relacionado estruturalmente com o substrato. Como exemplo pode-se citar a inibição da succinato desidrogenase por malonato: CH2COOH CH2COOH CH2COOH COOH Ácido succínico (Substrato) Ácido malônico (Inibidor) Succinato desidrogenase Succinato desidrogenase CHCOOH CHCOOH Nenhuma reação Ácido fumárico (Produto) Todos os inibidores reversíveis são caracterizados por uma constante de dissociação, Ki, chamada de constante de inibição, que pode estar relacionada com a constante de dissociação de EI (KEI) ou de ESI (KESI). Para inibidores competitivos as duas equações seguintes pode ser escritas como: E+S ES E+P E+I EI sem reação Como a ligação do substrato e do inibidor ocorrem no mesmo sítio, o efeito do inibidor pode ser desfeito aumentando-se a concentração do substrato. O resultado é que o Vmax não se altera, mas a concentração necessária para atingir o Vmax é aumentada de forma que quando o = 0.5 Vmax: [S] = Km 1 + [I] Ki Onde a [I] é a concentração do inibidor. Pode ser observado pela equação acima que Ki é igual à concentração do inibidor que aparentemente dobra o valor de Km. Com este tipo de inibidor, Ki é igual a KEI, enquanto KESI é infinito pois ESI não é formado. Na presença de inibidor competitivo, a equação de Lineaweaver-Burk torna-se: 1 0 = Km Vmax 1 [S] 1+ [I] Ki + 1 Vmax Aplicação desta equação permite o diagnóstico de inibição competitiva (Figura 15.5a, página 593). O valor numérico de Ki pode ser calculado a partir do gráfico de Lineaweaver-Burk para a reação sem o inibidor e com o inibidor. Na prática, no 5 6 entanto, valore mais preciso é obtido através de um segundo gráfico (Figura 15.6, página 593). A reação é conduzida para várias concentrações do substrato na presença de algumas concentrações de inibidor, e em seguida constrói-se um gráfico de Lineawever-Burk para cada concentração do inibidor. Um segundo gráfico é construído plotando-se os diferentes valores de inclinação ou de Km aparente [Km’, que é igual a Km (1+ [I]/Ki) e que pode ser determinado através do intercepto no eixo 1/[S] ] versus concentração do inibidor. Em ambos os gráficos o intercepto no eixo de [I] dá o valor de –Ki. -Inibidor reversível não-competitivo Um inibidor reversível não-competitivo combina-se com a enzima em um sítio diferente do sítio ativo do substrato. Por mais que o substrato ainda possa se ligar ao complexo EI formando um complexo ternário ESI, este complexo não é capaz de converter substrato em produto e é chamado de complexo final “suicida”. Como a inibição envolve um sítio distinto do sítio catalítico, a inibição não pode ser revertida pelo aumento da concentração do substrato. A consequência é que Vmax e não o Km é reduzido, pois o inibidor não afeta a ligação do substrato à enzima, mas afeta a quantidade de ES que pode prosseguir em direção à formação do produto. Neste tipo de inibição KEI e KESI são idênticos e Ki é numericamente igual a ambos. Neste caso a equação de LineaweaverBurk torna-se: 1 0 = Km Vmax 1 [S] + 1 Vmax 1+ [I] Ki Uma vez que inibidores não-competitivos tenham sido diagnosticados, o valor de Ki é melhor determinado através de um segundo gráfico obtido plotando-se os diferentes valores de inclinação ou de 1/Vmax’ (intercepto no eixo 1/o) versus concentração de inibidor ([I]). Em ambos os gráficos o intercepto no eixo de [I] dá o valor de –Ki. - Inibidor reversível acompetitivo Um inibidor reversível acompetitivo pode-se ligar somente ao complexo ES e não à enzima livre e, portanto o inibidor se liga a um sitio que é criado durante a alteração conformacional da enzima promovida pela ligação ao substrato. O complexo ternário, ESI, resultante é chamado de complexo final “suicida”. Assim como com o inibidor não-competitivo, o efeito do inibidor não pode ser revertido pelo aumento da concentração do substrato, mas neste caso ambos Km e Vmax são reduzidos por um fator de (1+ [I]/Ki). Uma concentração de inibidor igual ao Ki, portanto irá diminuir o valor de Km e Vmax pela metade. Com este tipo de inibidor, KEI é infinito, pois o inibidor não pode se ligar à enzima livre e, portanto Ki é igual a KESI. Neste caso a equação de Lineaweaver-Burk torna-se: 1 Km 1 1 [I] 1+ = + Vmax [S] Vmax Ki 0 O valor de Ki é mais precisamente determinado a partir de um segundo gráfico de 1/Vmax’ ou I/Km’ versus a concentração do inibidor. Em ambos os gráficos o intercepto no eixo de [I] dá o valor de –Ki. 6 7 - Inibidor reversível misto Para alguns inibidores o complexo ESI possui alguma atividade catalítica ou o KEI e KESI não são iguais e nem infinitos. Nestes casos são obtidas cinéticas de inibição do tipo misto. Na inibição mista as retas obtidas nas reações sem inibidor e com inibidor sofrem intersecção acima ou abaixo do eixo 1/[S]. O valor de Ki pode ser determinado através de um segundo gráfico de inclinação ou de 1/Vmax’ versus a concentração do inibidor. Em ambos os gráficos o intercepto no eixo de [I] dá o valor de –Ki. A inibição não-competitiva pode ser classificada como um tipo especial de inibição mista. Inibição irreversível Inibidores irreversíveis, tais como compostos organofosforados e organomercúricos, cianeto, monóxido de carbono, sulfito de hidrogênio, combinam com enzima para formar ligação covalente estável. A extensão da inibição de uma enzima é dependente da constante de velocidade (e, portanto do tempo) para a formação da ligação covalente e também da concentração do inibidor presente. O efeito de inibidores irreversíveis, que não podem ser removidos por técnicas físicas como a diálise, é reduzir a quantidade de enzima disponível para a reação. A inibição envolve reações com grupos funcionais, como hidroxilas e sulfidrilas, ou com átomos de metais no sítio ativo ou alostérico. Assim, compostos organofosforados, diisopropil-fofofluoridato, reage com a serina do sítio ativo de esterases tais como a acetilcolinesterase, enquanto compostos organomercúricos como o p-hidroximeriobenzoato reage com cisteínas, em ambos os casos resultando na formação de ligações covalentes e inibição enzimática. Tais inibidores são valiosos n estudo de sítio ativo de enzimas. Aplicações da inibição enzimática O estudo da classificação e dos mecanismos de inibição enzimática é de importância em diversos aspectos: - fornece informações sobre o mecanismo pelo qual a enzima promove a atividade catalítica (mais detalhes na seção 15.4.1 página 611); - fornece informações de possíveis mecanismos de regulação de atividades metabólicas in vivo; -permite a síntese de inibidores específicos para serem utilizadas como agentes terapêuticos bloqueando vias metabólicas chaves envolvidas em condições clínicas (mais detalhes na seção 18.1.2, página 709). Link para as figuras http://www.cambridge.org/gb/knowledge/isbn/resources/item2713153/?site_locale=en_GB# Chapter 15 GR01: Fig.15.1 Figura do estado pré-estacionário GR02: Fig.15.2 Cálculo de o GR03: Fig.15.3 Efeito da [S] na o e efeito de diferenes concentrações de inibidores GR04: Fig.15.4 Gráficos Lineaweaver-Burk, Hanes e Eadie-Hofstee GR05: Fig.15.5 Gráficos Lineaweaver-Burk mostrando o efeito de 3 tipos de inibidores (a) GR06: Fig.15.6 Gráfico Lineawever-Burk (a) e Gráfico para determinação de Ki determination (b) 7
Download







![+ [E] [S] - Sistemas EEL - Universidade de São Paulo](http://s1.livrozilla.com/store/data/000150897_1-f33431079ef06af434a6636d8f76dc77-260x520.png)
