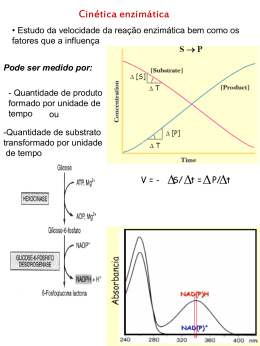
Aula de enzimologia Tema Cinética enzimática Prof. Adriane M. F. Milagres Departamento de Biotecnologia - Escola de Engenharia de Lorena Universidade de São Paulo – USP [email protected] Cinética das reações catalisadas por enzimas 1. Efeito da concentração de substrato Conteúdo: • Cinética de uma reação simples • Determinando Vmax e Km • Significado de Km • Cinética do tipo cooperativo A atividade de uma enzima e a concentração do substrato não são, em geral, proporcionais Qual a porcentagem dos sítios ativos estão ocupados? Por que estudar a cinética enzimática? • Determinar as constantes cinéticas do S e dos inibidores • Ajudar a elucidar os mecanismos de reação • Determinar a função de uma enzima em uma rota metabólica • Conhecer as condições ótimas de catálise A velocidade da reação é proporcional a S Hipótese de equilíbrio rápido e estado estacionário O modelo de Michaelis-Menten é útil para explicar a cinética das reações catalisadas por enzimas. O modelo de Michaelis-Menten considera que uma reação enzimática ocorre em dois passos: V = k3 [ES] K1 [E] [S] = K2 [ES] K2 = [E] [S] K1 [ES] 1) V = k3 [ES] 2) [Et] = [E] + [ES] V = k3 [ES] [Et] [E] + [ES] [E] [S] V = K3 ks Et E + [E] [S] ks V= Vm [S] ks + [S] K2 = Ks = [E] [S] K1 [ES] [ES] = [E] [S] ks Hipótese de Briggs - Haldane ETAPA 1. Ligação de um substrato (S) a uma enzima (E), formando um complexo intermediário (ES) ETAPA 2.Formação do produto (P) a partir do complexo ES, com recuperação da forma livre da enzima (E) A reação do anterior está representada no equilíbrio: onde k1, k2, k3e k4 são as constantes de velocidade de cada etapa. Nesse caso, a da reação(V), ou seja, a velocidade de formação do produto será: Porém, no estado inicial, podemos simplificar a reação: A velocidade inicial de reação neste caso é dada por: Na análise cinética da reação catalisada por uma enzima, consideramos apenas o ESTADO ESTACIONÁRIO, que é aquele em que, apesar de estarem mudando as concentrações de S (diminuindo) e de P (aumentando), não há variação da concentração dos intermediários da reação. Velocidade de formação de ES =Velocidade de decomposição de ES ou...k1[E].[S] = (k2+ k3)[ES] (eq. 3) A equação 3 pode ser re-arranjada em: Para simplificar a equação 4, foi definida uma constante, Km, conhecida como Constante de Michaelis: No numerador, temos duas constantes de velocidade de reações de DECOMPOSIÇÃO de ES e no denominador, a constante de velocidade da FORMAÇÃO de ES. Dessa forma, Km é uma medida da AFINIDADE da enzima pelo substrato. Km ALTO = Baixa afinidade e Km BAIXO = Alta afinidade Como toda a enzima que estiver na solução de reação (ETOTAL) corresponde à soma das espécies E (enzimas livres) e ES (enzimas no complexo com substrato), Podemos substituir esta equação na da velocidade inicial da reação é Vo = k3.[ES]: Quando todas as enzimas estão na forma de complexo ES, atingimos a velocidade máxima de reação, ou seja, se [E]TOTAL= [ES], então a equação 10, pode ser representada por: •Se [S]<<<Km, então: Vo = Vmax [S] Km •E se [S] >>>> Km, Vo = Vmax Vo = K[S] V0= k3[E]TOTAL •Se V0=Vmáx/2, temos: Km = [S]. Ou seja, Km corresponde à concentração de S necessária para se atingir a metade da velocidade máxima! Significado de Km • Importante parâmetro da reação enzimática e da função biológica • Fornece uma medida da [S] para que ocorra uma catálise significativa • Km esta relacionado as constantes de velocidade de cada etapa da reacão Significado do kcat/KM: A Eficiência Catalitica • É uma medida de eficiência da Enzima • Permite comparar a preferência de uma Enzima para diferentes Substratos Significado do kcat/KM: A perfeição cinética Determinação experimental dos parâmetros cinéticos Diagrama Lineweaver-Burk (Duplo-Recíproco) As concentrações de substrato escolhidas devem ser proximas do Km Críticas ao gráfico L.B. 1) 2) 3) Aumentos iguais de S que fornecem pontos igualmente espaçados no grafico V x S não fornecem pontos igualmente espaçados no L.B. Valores tendem a se agrupar próximo ao eixo 1/v e aparecem poucos pontos mais altos da escala e são os que devem pesar no traçado da reta Pequenos erros na determinação de V se tornam maiores quando se calcula o seu recíproco. Gráfico de Eadie-Hofstee Não envolve o recíproco de V e podem tornar mais precisos v vV K max m [S] Vmax v Inclinação = -Km Vmax Km v [S] Gráfico de Hanes-Woolf Mais indicado para dados obtidos com aumentos iguais de S K [S] 1 m [S] v V V max max [S] v Inclinação = 1 Vmax Km Vmax -Km [S] Exercício: 1) Os seguintes dados foram obtidos para uma enzima que catalisa a reação S-P. As concentrações de substrato abrangem uma faixa bastante ampla para nos permitir utilizar qualquer um dos gráficos lineares. Trace os gráficos e determine Km e Vmax. [S] (M) V (nmoles/L/min) 8,33 10-6 13,8 1 10-5 16 1,25 10-5 19 1,67 10-5 23,6 2 10-5 26,7 2,5 10-5 30,8 3,33 10-5 36,3 4 10-5 40 5 10-5 44,4 6 10-5 48 8 10-5 53,4 1 10-4 57,1 2 10-4 66,7 INFLUÊNCIA DA CONCENTRAÇÃO DE SUBSTRATO Este gráfico mostra como varia a velocidade inicial de uma reação com o aumento da concentração de substrato: Ou seja,Vmáx e Km podem ser calculados quando V0 é medida em função de várias concentrações de substrato. 1) Quando [S] é muito grande – V = Vmax P = Vmax . t Ordem da reação 2) Quando S é muito pequeno Vo = Vmax [S] Km Vo = K[S] K é uma constante de primeira ordem (min -1) -dS = kS dt d S 1 k S dt S 0 2,3 log S k t t 0 Exercício: 1) Uma enzima teve sua atividade determinada a uma concentração inicial de [S] de 2 x 10-5 M. Em 6 min, metade do substrato foi utilizado. O Km para o substrato é de 5 x 10 -3 M . Calcule a) k, b) Vmax, c) concentração de produto formado em 15 min. Enzimas Alostéricas • Não obedecem a Cinética de Michaelis-Menten • Quanto maior a [S] maior será a atividade da E até esta alcançar o Vmax • A curva da V versus [S] e sigmóide • Segue modelo da curva de saturação da Hemoglobina com O2 • Sistema cooperativo Enzimas alostéricas possuem uma região diferente do sítio ativo e se liga um efetor ou modulador alostérico. A mudança conformacional decorrente da ligação do efetor alostérico se propaga pela molécula e afeta o sítio ativo, ativando-o ou inibindo-o. Ativador alostérico Inibidor alostérico Gráfico V x S é uma curva sigmóide Enzimas com sítios múltiplos 1) Sitios independentes (hiperbólica) 2) Sítios interdependentes (Sigmoidal) Enzimas tipo V: efetores alostéricos alteram a Vmax - hiperbólica Enzimas tipo K: efetores alostéricos alteram o Km - Cinética sigmoidal (indica cooperatividade) k’ k3 E + hS ------ ESh ------- ESh-1 + P V = k3 [ESh] (1) Et = [E] + [ESh] [ESh] = [E] [S]h / k’ V = k3 [ESh] Et [E] + [ESh] V = k3 [E] [S]h / k’ Et [E] + [E] [S]h / k’ V = k3 [S]h [Et] k’ + [S]h V = Vm [S]h K’ + [S]h Equações de V x [S] [S] é a concentração de substrato S50 é a concentração de substrato para a qual a enzima está hemisaturada e em que a velocidade é metade de Vmax. h é o coeficiente de Hill e é uma medida do grau de cooperatividade (ou sigmoidicidade): quando h=1 a equação acima simplifica e é igual à equação de Michaelis-Menten (ausência de cooperatividade). A equação de Hill também é linearizável: V= Vm [S]h K’ + [S]h Rearranjando: vK’ + v[S]h = Vm [S]h Vk’ = Vm[S]h –v[S]h Vk’ = (Vm – v) [S]h V = [S]h Vm – V k’ Log ( V ) = h log [S] - log k’ ( Vm – V ) (Equação de Hill) Exercício: Determine se a enzima obedece uma cinetica hiperbólica ou sigmoidal e calcule ou estime as constantes cinética apropriadas (Km, Vmax ou K’ [S]0,5 , nap e Vmax) [S] (M x 104) 6,5 12,5 25 50 100 200 400 800 V (micromoles/L/min) 1,54 5,88 20 50 80 94,12 98,46 99,61 Considerações finais: 1) O estudo cinético de uma enzima nos informa sobre o modo como a atividade da enzima se modifica quando se alteram as condições do meio em que esta é ensaiada. 2) O estudo cinético de uma enzima é importante para caracterizar essa enzima, desta maneira distinguindo-a funcionalmente das demais enzimas inclusive das que podem catalisar a mesma reação. 3) O desenho de condições de ensaio adequadas à dosagem de uma enzima numa preparação biológica complexa é feita com base em estudos de cinética.
Download