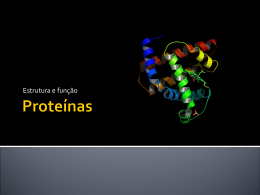
Proteínas São as macromoléculas mais abundantes, fazendo parte da estrutura de todas as células. São instrumentos moleculares da informação gênica. DNA RNA Proteína Apresentam uma variedade enorme, e desempenham diferentes funções biológicas. Funções de Proteínas Estrutura (colágeno, queratina); Transporte (hemoglobina, albumina); Defesa (Imunoglobulinas); Sinalização (receptores de hormônios); Catálise enzimática (enzimas hepáticas); Movimento (contração muscular); Combustíveis (gliconeogênese). Aminoácidos São as unidades monoméricas das proteínas Todos os aminoácidos possuem um grupo carboxil, um grupo amino, um Hidrogênio e um Grupamento Lateral ligados a um Carbono α (α-aminoácidos) Os 20 aminoácidos encontrados nas proteínas Aminoácidos com cadeia lateral apolar Aminoácidos com cadeia lateral polar Aminoácidos com cadeia lateral contendo anel aromático Aminoácidos com cadeia lateral carregada positivamente Aminoácidos com cadeia lateral carregada negativamente Propriedades gerais dos aminoácidos Em pH neutro os aminoácidos são dipolares, ou “zwitterions”: grupo amino protonado – NH3+ (íon amônio) grupo carboxil desprotonado – COO- (íon carboxilato) pK=2 pK=9-10 Estereoisomeria nos aminoácidos Exceção: Aminoácidos Proteinogênicos Aas não-proteinogênicos Ligação Peptídica Ligação Peptídica Cadeia Polipeptídica Determinação da sequência de aminoácidos de uma proteína DNA (genes) Transcrição RNA mensageiro Tradução Proteína Estrutura de Proteína A sequência de aminoácidos em uma proteína é chamada estrutura primária. Estrutura secundária Arranjo espacial local dos aminoácidos dentro de uma cadeia polipeptídica. α-hélice Folhas β Curvaturas β α- hélice Folhas β Curvaturas β Estrutura Terciária É o arranjo tridimensional total dos aminoácidos na cadeia polipeptídica. Similaridade de sequência x estrutura Estrutura Quaternária Algumas proteínas são formadas por mais de uma cadeia polipeptídica, ou subunidades, que podem ser idênticas ou diferentes. O arranjo das subunidades de uma proteína em complexos tridimensionais constitui a estrutura quaternária. Dobramento Protéico Interação hidrofóbica É a principal força que governa a estrutura de uma proteína. Força os aminoácidos apolares para o interior da molécula para diminuir o contato com a água. Mioglobina Hidrofóbicos Polares Carregados Dobramento Protéico Clara ► Albumina Calor Albumina desnaturada Dobramento Protéico Chaperonas x dobramento protéico Hsp70 Chaperonas x dobramento protéico Chaperoninas (Hsp60) Doença da vaca louca - Príon As PrPs estão classificadas em dois grupos, de acordo com sua conformação. PrPc – forma celular da proteína prion normal (fig. a). PrPsc – forma scrapie com conformação diferente da proteína celular (fig. b). A proteína infecciosa é capaz de mudar a forma da proteína celular irreversivelmente. Desnaturação Alteração drástica na estrutura tridimensional nativa de uma proteína levando a alterações nas propriedades físico-químicas e perda de função biológica. Pode ser causada por calor, ácidos ou bases fortes, solventes orgânicos, etc. Desnaturação pelo calor Clara ► Albumina Calor Albumina desnaturada Desnaturação por alteração do pH Caseína desnaturada Coalho Agentes Desnaturantes Muitos hormônios, antibióticos, antitumorais e antivirais são peptídios. Devem ser estocados em baixas temperaturas e não devem ser ingeridos com alimentos ácidos ou básicos. Bioquímica do permanente e da chapinha Agente redutor + Calor = Rompimento das hélices
Download