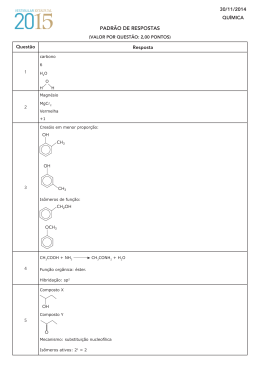
CENTRO EDUCACIONAL SIGMA :: 3ªsérie QUÍMICA 2.3 Dado: M CH 4 = 16 g/mol 2º período QUESTÃO 4 QUESTÃO 1 Dado o esquema a seguir, estabelecido nas condições padrão: O diagrama abaixo se refere aos líquidos A, B e C. H 2H2(g) + CO(g) + 3 O 2(g) 2 CH 3 OH(l) + 3 O2(g) 2 H = –204 kcal H=–173 kcal CO2(g) + 2H2O(l) caminho da reação Com base no diagrama e em conhecimentos correlatos, faça o que se pede. (A) Coloque os líquidos apresentados no gráfico em ordem crescente de volatilidade. (B) A adição de um soluto não-volátil aumenta ou diminui a pressão máxima de vapor? Justifique a sua resposta. QUESTÃO 2 Sabendo que a entalpia padrão de formação do CO(g) é igual a –26 kcal/mol, calcule, em kcal, a entalpia padrão de formação do metanol líquido. QUESTÃO 5 A equação a seguir representa a reação de monobromação do etano. H3C – CH3 + Br2 d H3C – CH2 – Br + HBr Sejam dadas as seguintes soluções aquosas: Calcule a variação de entalpia, em kcal, para esse processo. P X - 0,25 mol/L de glicose (C6H12O6); Dados: P Y - 0,25 mol/L de carbonato de sódio (Na2CO3); P Z - 0,5 mol/L de cloreto de potássio (KCl); P W - 0,5 mol/L de sacarose (C12H22O11) Considerando-se 100 mL de cada solução e dissociação completa das substâncias iônicas, faça o que se pede. (A) Coloque as soluções acima em ordem decrescente de temperatura de ebulição. (B) Calcule a quantidade, em mol, de partículas dispersas na solução de maior pressão osmótica. Obs.: A questão somente será corrigida se apresentados os cálculos. QUESTÃO 3 O gráfico abaixo indica os calores ou entalpias de combustão do enxofre monoclínico e do enxofre rômbico, nas condições padrão. H S(monoclínico) + O2(g) Energia de ligação em kcal/mol C — Br 68 Br — Br 46 C— H 99 H — Br 87 C—C 83 QUESTÃO 6 Uma cidade que produza aproximadamente 6 milhões de m3 de esgoto por dia, ao cuidar desse problema indesejável de maneira adequada, poderá obter a cada 1 m3 de esgoto produzido até 0,070 m3 de biogás, em que 50% dessa mistura gasosa é metano e que cada 1 m3 de metano corresponde a 1 litro de gasolina. Quando 1 mol de metano sofre combustão, há a liberação de 890 kJ. Em relação ao metano e assuntos correlatos, faça o que se pede. (A) Escreva a equação química que representa aproveitamento do metano como combustível. S(rômbico) + O2(g) H= – 71,1 kcal/mol Tipo de ligação o (B) Quantos litros de gasolina seriam economizados mensalmente se todo o esgoto dessa cidade fosse tratado para produzir metano? H = –71,0 kcal/mol SO2(g) caminho da reação (C) Quantos quilojoules de energia seriam liberados se todo o metano produzido fosse queimado? Com base no gráfico e em conhecimentos correlatos, calcule, em kcal, a variação de entalpia referente a transformação de 16 g de enxofre rômbico em enxofre monoclínico. Dados: M(S) = 32 g/mol. AVALIAÇÃO DISCURSIVA DE QUÍMICA :: 2º período | 3ª SÉRIE :: ENSINO MÉDIO | 23M2Qui_2009_pro.lwp PÁG. 1 CENTRO EDUCACIONAL SIGMA :: QUESTÃO 7 QUESTÃO 10 Considere a reação representada abaixo: O H3C + CH3OH C Com relação aos compostos apresentados e lavando-se em consideração as suas propriedades, responda: O H3C OH + H2O C O (I) (II) H O COOCH3 CH3 (IV) (III) A maioria dos ésteres de pequena massa molar é constituída de líquidos de cheiro agradável. Essas substâncias são voláteis e solúveis em água. Em relação aos ésteres e assuntos correlatos, faça o que se pede. (A) Escreva os nomes dos produtos da equação química representada. (B) Escreva a fórmula estrutural e o nome de um isômero de função da substância III. ; H 2C COOH ; CH2COOH (I) (II) (III) (A) A função química presente no composto I. (B) A nomenclatura oficial (IUPAC) para o composto II. (C) Escreva a equação que representa a reação de obtenção do composto III. (C) Escreva a equação e o nome do éster formado pela reação da substância II com o ácido 3-metilbutanoico. QUESTÃO 8 Além dos compostos orgânicos naturais presentes em todos os alimentos que ingerimos, o ser humano conseguiu sintetizar um número muito grande de novos compostos orgânicos, que são de grande importância para a raça humana nos dias atuais. Abaixo são representados alguns compostos orgânicos. (I) H3 C (II) CH3 H O H C C C CH3 O C CH3 OH CH3 (III) (IV) CH3 CH3 O H H H3 C CH2 O CH2 CH3 H3C H Escreva o nome oficial dos compostos I, II, III e IV. QUESTÃO 9 No preparo dos fogos de artifício, as substâncias são agregadas com o auxílio de um solvente. Diversos compostos, como a propanona (acetona) e o isopropanol, podem ser usados para este fim. Escreva a fórmula em bastão desses dois compostos e indique qual deles possui a maior temperatura de ebulição à pressão atmosférica. Justifique a sua resposta. AVALIAÇÃO DISCURSIVA DE QUÍMICA :: 2º período | 3ª SÉRIE :: ENSINO MÉDIO | 23M2Qui_2009_pro.lwp PÁG. 2 CENTRO EDUCACIONAL SIGMA :: 3ªsérie 2.3 QUÍMICA 2º período :: 25/5/2009 QUESTÃO 1 (A) (0,5) (B) (0,5) QUESTÃO 4 (1,0) QUESTÃO 2 (A) (0,5) (B) (0,5) QUESTÃO 5 (1,0) QUESTÃO 3 (1,0) AVALIAÇÃO DISCURSIVA DE QUÍMICA :: 2º período | 3ª SÉRIE :: ENSINO MÉDIO | 23M2Qui_2009_pro.lwp PÁG. 1 CENTRO EDUCACIONAL SIGMA :: QUESTÃO 6 (A) (0,2) QUESTÃO 9 Fórmulas: (0,6) (B) (0,4) Justificativa: (0,4) QUESTÃO 10 (C) (0,4) (A) (0,3) (B) (0,3) (C) (0,4) QUESTÃO 7 (A) (0,2) III IV (B) (0,4) (C) (0,4) QUESTÃO 8 I. (0,25) II. (0,25) III. (0,25) IV. (0,25) AVALIAÇÃO DISCURSIVA DE QUÍMICA :: 2º período | 3ª SÉRIE :: ENSINO MÉDIO | 23M2Qui_2009_pro.lwp PÁG. 2
Baixar