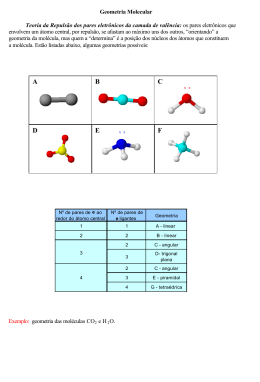
VSPER – VALENCE SHELL ELECTRON PAIR REPULSION Por Marco César Prado Soares – Engenharia Química – Universidade Estadual de Campinas – UNICAMP – 2013 Na linguagem VSEPR a molécula é escrita como AXnEm, em que A é o central, X os ligantes e E os pares isolados. Assim, n é o numero de ligantes e m o numero de pares isolados. Em algumas literaturas, fala-se no número estérico ( de "estereos" - forma), que é dado por n+m. Esse número nos diz a hibridização e, portanto, a geometria dos pares (lembrando: a geometria NÃO é consequência da hibridização, a hibridização é uma construção matemática para explicar a ligação química), pois n+m é exatamente o número de orbitais envolvidos. Vejamos: n+m=2 indica que temos dois orbitais envolvidos. Logo, a hibridização é sp (1 s e 1 p) => geometria linear 2 n+m=3 indica 3 orbitais => sp (1 s e 2 p) => geometria triangular planar n+m=4 => 4 orbitais => sp3 (1 s e 3p) => geometria tetraédrica n+m = 5 => 5 orbitais => sp3d (1 s, 3p e 1 d) => bipiramidal trigonal n+m=6 => 6 orbitais => sp3d2 => octaédrica Lembrando, essa é a geometria dos pares de elétrons da molécula Alguns modelos comuns: (Imagem retirada da página http://www.molecularmodelscompany.com/Products/VSEPR/VSEPRtheorychart.aspx). Assim escreve J.D Lee em seu livro Química Inorgânica não tão Concisa: "É um engano comum admitir que a hibridização é a causa de uma determinada estrutura molecular. Não é esse o caso. A razão pela qual uma dada estrutura molecular é adotada é sua energia. Também é importante lembrar que a hibridização é uma etapa teórica que foi introduzida na passagem de um átomo para uma molécula. O estado hibridizado não existe na realidade. Ele não pode ser detectado nem mesmo espectroscopicamente, de modo que as energias de orbitais híbridos não podem ser medidas; só podem ser estimadas teoricamente." Traduzindo: o modelo segundo o qual os elétrons vão para um estado de energia intermediária antes de fazer a ligação é uma construção matemática para tentar explicar como a ligação é formada. Por isso falamos em TEORIA das ligações de valência e TEORIA do orbital molecular. São construções TEÓRICAS, é impossível observar na prática.
Baixar