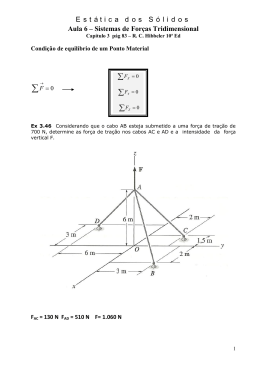
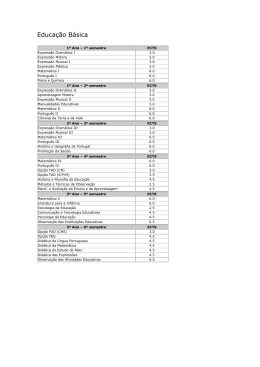
A.4.7 - FÍSICO-QUÍMICA Cálculo do efeito da água na estrutura eletrônica do Dinucleótido de Flavina e Adenina (FAD) utilizando simulação QM/MM sequencial. 1 *Renan F. Guerra , Eduardo F. Franca² 1. Mestrando do Programa de Pós-Graduação em Química da Universidade Federal de Uberlândia - UFU; *[email protected] 2. Pesquisador do Instituto de Química da Universidade Federal de Uberlândia – UFU. Palavras Chave: FAD, Efeito do Solvente, QM/MM Sequencial. Introdução As flavoproteínas utilizam a estrutura original e versátil das porções de flavina para catalisar reações 1 redox bioquímicas de cinética lenta . O FAD é a mais 2 complexa e abundante forma de flavina exercendo papel relevante como cofator de diversas enzimas (FADdependent) dado o seu elevado potencial de redução. A Acetohidroxiácido Sintate (AHAS) enzima inibidora de herbicidas, por exemplo, para sua atividade necessita fundamentalmente de cofatores como o TPP e 2+ + os íons Mg e K , mas também do FAD. No entanto, o papel do mesmo na enzima, ainda permanece um enigma, mas sabe-se que é essencial para a integridade estrutural 3 e atividade enzimática . O presente trabalho objetivou estudar a conformação estrutural e as propriedades moleculares da molécula de FAD em solução aquosa, haja vista que os meios líquidos podem afetar significativamente as propriedades eletrônicas e conformacionais das moléculas. Para tanto, foi utilizado um método híbrido de mecânica quântica e mecânica molecular (clássica), conhecido como QM/MM Sequencial, considerado adequado para estudos com esse foco já que a região de interesse (FAD) é tratada quanticamente e o meio no qual se encontra inserida (solvente) é tratada por cálculos clássicos demandando menor custo computacional que os métodos puramente quânticos. Resultados e Discussão Inicialmente foi realizada uma simulação por dinâmica molecular da estrutura do FAD em solvente explícito (Single Point Charge – SPC), com parâmetros de campo de força obtidos online pelo programa 4 SwissParam , inseridos numa caixa de simulação retangular a 1,5 nm do sistema mantido em ensemble isotérmico-isobárico NPT (298 K e 1 bar). O programa GROMACS 4.5.3 foi utilizado nas simulações com o campo de força CHARMM 2.7. O tempo total de simulação foi de 4 ns. A cada ps de simulação a estrutura eletrônica do FAD foi determinada utilizado cálculos semi-empíricos single point, utilizando o Hamiltoniano PM7 e o programa MOPAC 2012. a) O cálculo da raiz quadrada do desvio quadrático médio (RMSD) aponta para um desvio máximo de 0,46 nm relacionado a flutuações conformacionais da estrutura ao longo da trajetória. Já o cálculo da raiz quadrada média da flutuação (RMSF) das estruturas mostra que os grupos centrais da molécula de FAD, ou seja, aqueles contendo grupos sulfonados são os que apresentam menor mobilidade estrutural. Em relação aos orbitais de fronteira, HOMO e LUMO, verificou-se que a variação estrutural resultou na diminuição de energia em aproximadamente 0,295 eV. Os orbitais HOMO encontram-se localizados no agrupamento SO4 tanto para a estrutura inicial (Fig. 1a) quanto para a mais estável (Fig 1b), no entanto, ocorre um deslocamento diminuindo a extensão do mesmo de 5 para apenas 2 átomos, conforme observa-se ao comparar as representações das Fig. 1a e 1b. Figura 2. Ligações de Hidrogênio (em vermelho) responsáveis pela conformação da estrutura mais estável A estrutura mais estável se apresenta numa conformação mais fechada ocasionada pela ocorrência de duas ligações de hidrogênio intramoleculares (Fig. 2) tempo de vida médio de 3,49 ps - com momento dipolar em solução maior em 1,97 Debyes. Conclusões O método de QM/MM Sequencial permitiu a descrição adequada do efeito do solvente explícito, temperatura e pressão na estrutura eletrônica do FAD, reafirmado a validade da metodologia híbrida no estudo das propriedades termodinâmicas de moléculas com elevado grau de liberdade como é o caso do FAD. Portanto, as moléculas de água tratadas como cargas pontuais amostraram conformações mais estáveis para a estrutura do dinucleotídeo em questão. As informações até então obtidas servem de base para o estudo da importância da estrutura do FAD como cofator da enzima AHAS. b) Agradecimentos CNPq, FAPEMIG ____________________ 1 Monteira, M. Cambridge, UK: The Royal Society of Chemistry. p. 94. 2013. Macherouxd, P; Kappes,B.; Steven, E. EalickFEBS Journal. 278, p. 2625– 2634, 2011. 3 Mccourt, J. A. et al. Proc. Natl. Acad. Sci. USA, Brisbane, 103 (3), p. 569-73, 2006. 4 Zoete, V.; Cuendet, M. A.; Grosdidier, A.; Micheelin, O. J. Comput. Chem. 32 (11), p. 2359-68, 2011. 2 Figura 1. Orbitais moleculares HOMO nas estruturas inicial (a) e mais estável em solução aquosa (b). 67ª Reunião Anual da SBPC
Baixar