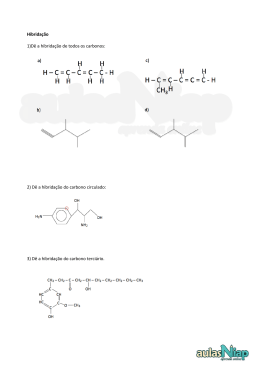
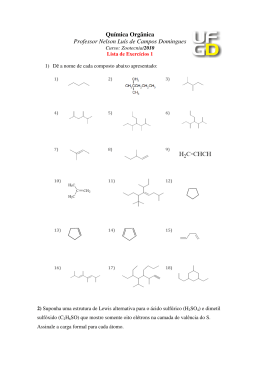
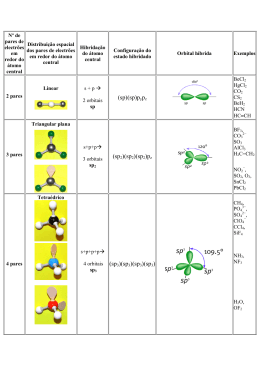
INTRODUÇÃO À QUÍMICA ORGÂNICA Química Professora: Raquel Malta 3ª série – Ensino Médio HISTÓRICO Jöns Jakob Berzelius - Teoria da força vital ou Teoria do vitalismo. Compostos orgânicos só podiam ser sintetizados na presença de vida. Friedrich Wöler – queda da teoria da força vital Síntese da ureia a partir do cianato de chumbo II. QUÍMICA ORGÂNICA Área da química que estuda as propriedades físico-químicas dos compostos do elemento carbono. ATENÇÃO!!! Alguns exemplos de compostos que apresentam átomos de carbono em sua composição mas não possuem propriedades de compostos orgânicos: CO, CO2, HCN e seus derivados, Cgrafite, Cdiamante, H2CO3 e seus derivados. Postulados de Kekulé O carbono é tetravalente. As quatro valências do carbono são iguais. Os átomos de carbono podem ligar-se entre si, originando cadeias. De acordo com Kekulé, a molécula de metano (CH4) seria representada da seguinte forma: Com a descoberta de novos fenômenos químicos, houve a necessidade de aperfeiçoar o modelo de molécula plana apresentado. Le Bel e Van’t Hoff propuseram o modelo tetraédrico espacial. Como explicar satisfatoriamente a tetravalência do carbono? Configuração eletrônica do carbono no estado fundamental: O carbono seria bivalente!? Teoria da Hibridização ou da Hibridação: passagem de um elétron do orbital 2s para 2p. Hibridações: sp3, sp2 e sp HIBRIDAÇÃO sp3 Passagem de um elétron do orbital 2s para 2p vazio – estado ativado. Fusão do orbital s com os 3 orbitais p – hibridação sp3. HIBRIDAÇÃO sp3 Formação de quatro ligações sigma (σ) Geometria: tetraédrica. Ângulo entre os ligantes: 109 °28’ HIBRIDAÇÃO sp2 Passagem de um elétron do orbital 2s para 2p vazio – estado ativado. Orbital p puro Fusão do orbital s com 2 orbitais p permanecendo um orbital p puro – hibridação sp2. HIBRIDAÇÃO sp2 Formação de três ligações sigma (σ) e uma pi (π). Geometria: trigonal plana. Ângulo entre os ligantes: 120 ° HIBRIDAÇÃO sp Passagem de um elétron do orbital 2s para 2p vazio – estado ativado. Orbital p puro Fusão do orbital s com 1 orbital p permanecendo 2 orbitais p puros – hibridação sp. HIBRIDAÇÃO sp Formação de duas ligações sigma (σ) e duas pi (π). Geometria: linear. Ângulo entre os ligantes: 180 ° Resumindo... Hibridação Tipo de ligação sp3 Representação Geometria Ângulo 4σ Tetraédrica 109 ° 28’ sp2 3σ 1π Trigonal 120 ° sp 2σ 2π Linear 180 ° ou
Baixar