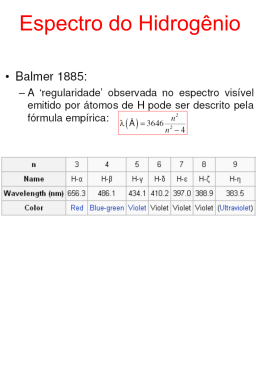
QUÍMICA Prof. Daniel Pires O ÁTOMO DE BOHR Para explicar a estabilidade do átomo, o físico dinamarquês Niels Bohr admitiu que um gás emite luz quando uma corrente elétrica passa através deste, devido aos elétrons em seus átomos primeiro absorverem energia da eletricidade e posteriormente liberarem aquela energia na forma de luz. Ele imaginou que a radiação emitida é limitada para um certo comprimento de onda. Deduziu então que, em um átomo, um elétron não está livre para ter qualquer quantidade de energia. Ele pode ter somente certas quantidades de energia, isto é, a energia de um elétron em um átomo é quantizada. No século XIX acreditava-se que a luz e outras formas de radiação eletromagnética eram fluxos contínuos de energia. Mas, no início do século XX, os físicos alemães Max Planck e Albert Einstein mostraram independentemente que todas as radiações eletromagnéticas comportavam-se como se fossem compostas por minúsculos pacotes de energia denominados fótons. Cada fóton tem uma energia proporcional à frequência da radiação. E fóton = h u Onde:: -34 h = 6,63 · 10 J.s (constante de Planck) u = frequência Já vimos que a frequência, o comprimento de onda e a velocidade da luz estão relacionados pela equação c = u l, que, substituindo, obtemos: E fóton = hc / l Dessa equação podemos ver que um fóton de energia eletromagnética tem sua energia e comprimento de onda relacionados em uma proporcionalidade inversa (lembre-se: h e c são constantes). Segundo Bohr, cada elétron pode Ter somente um valor de energia. Ele estabeleceu que um átomo tem um conjunto de energias quantizadas, ou níveis de energia, disponível para seus elétrons e cada nível de energia tem uma quantidade máxima de elétrons. Um átomo está normalmente em seu estado fundamental, no qual todos os seus elétrons estão nos níveis de energia mais baixos que lhes são disponíveis. Bohr conseguiu calcular a energia absorvida numa transição eletrônica no átomo de hidrogênio. Para tanto, utilizou a seguinte equação: (o sinal negativo indica que a energia é absorvida) 2 2 E total = - R (z / n ) Onde: z = número atômico do elemento 23 n = 6,02 · 10 (número de Avogadro) O raio atômico também pode ser calculado pela equação: 2 Raio = Ao (n / z) Onde: -10 Ao = 0,529 · 10 m (Raio de Bohr - constante) Estas equações podem ser aplicadas a qualquer átomo ou íon hidrogenóide, isto é, com apenas um elétron, mas não se aplicam a outros elementos com mais de um elétron. Isso porque as repulsões intereletrônicas teriam que ser levadas em consideração nas transições eletrônicas e no tamanho do raio atômico. Sabia-se no século XIX que a luz exercia efeito sobre alguns metais, removendo elétrons de uma chapa metálica lisa no vácuo. Esse fenômeno ficou conhecido como efeito fotoelétrico. Quando um átomo absorve energia de uma fonte externa, alguns de seus elétrons ganham energia e são elevados a um nível de energia maior. Esse fenômeno é chamado de salto quântico. Diz-se que o átomo se encontra num estado excitado. Alguns dos níveis de energia mais baixos ficam livres e, assim, um elétron pode cair de um nível mais alto para um nível de energia mais baixo. Quando Isso acontece, a energia absorvida pelo elétron é liberada na forma de fóton de radiação eletromagnética, com um comprimento de onda diferente do original. 1 Esse fenômeno é chamado de fluorescência. Muitas substâncias ficam fluorescentes quando atingidas por luz ultravioleta, a qual não podemos enxergar - vemos apenas a luz de baixa energia produzida pela fluorescência. O fóton, portanto, corresponde à diferença entre dois níveis de energia de um elétron, quando este realiza um salto quântico. Uma vez que a energia do fóton é quantizada, o comprimento de onda também deve ser quantizado, ou seja, só pode um par específico de níveis em um ter um valor discreto e fixo. Cada transição eletrônica entre átomo contribui para a produção de uma linha individual no espectro daquele elemento. O ponto mais fraco da teoria atômica de Bohr reside na sua concepção de um modelo atômico planetário modificado, no qual cada nível quantizado de energia corresponde a uma órbita eletrônica circular, específica e estável, com raio quantizado. Outros mais tarde estenderam o modelo de Bohr a órbitas elípticas. Por razões que se tornarão evidentes adiante, não falaremos mais em elétrons percorrendo órbitas ao redor do núcleo. Como Bohr encarou o fato de que os elétrons não irradiam energia continuamente, o que causaria o colapso no átomo? Em primeiro lugar, desde que a energia de um elétron é quantizada, a radiação contínua não é possível, pois a energia do elétron teria de variar continuamente para que o elétron fosse capaz de perder energia continuamente. Em segundo lugar, Bohr foi capaz de mostrar que a menor energia utilizável para um elétron não é zero. Ele interpretou isto como significando que há um tamanho mínimo permitido para a órbita de um elétron. Embora os conceitos de órbitas de Bohr sejam incorretos, acreditamos hoje que há realmente uma energia mínima constante, maior do que zero, que um elétron pode ter. De acordo com Bohr, os átomos não entram em colapso porque eles não podem ter menos energia do que em seu estado fundamental. 2
Baixar