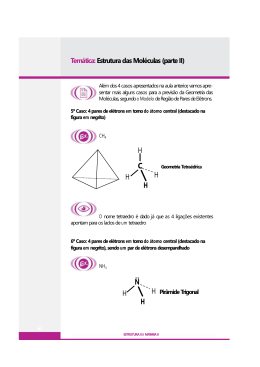
Excitação eletrônica Absorção de Energia Emissão de Energia Excitação eletrônica: elétron recebe ENERGIA e passa para camada mais externa. Tendência: voltar à camada original Retorno à camada mais interna com liberação da ENERGIA recebida FÓTON Luz Radiação eletromagnética que viaja no espaço com velocidade constante c = 3,0.108 m/s Teste de chama Sais de diversos elementos na chama Diferentes cores Sódio (Na): amarelo Cobre (Cu): verde Potássio (K): violeta Cálcio (Ca): vermelho-tijolo Bário (Ba): verde-limão Magnésio (Mg): branco Chumbo (Pb): azul-branco Luminescência Emissão de ENERGIA. Fluorescência Emissão de energia cessa assim que E deixa de ser fornecida. Ex: lâmpadas flurescentes, luminosos. Fosforescência Emissão de energia continua mesmo com a interrupção de fornecimento de energia. Ex: interruptores, relógios. Quimioluminescência Energia de emissão proveniente de uma reação química. Ex: sinalisadores de mergulhadores. Em organismos vivos: bioluminescência Ex: vaga-lume Átomo de Bohr Átomo de Bohr Camadas/Níveis K, L, M, N, O, P, Q Nº de elétrons - Camada K (2), L (8), M (18), N (32), O (32), P (18), Q (8) 1, 2, 3, 4, 5, 6, 7 Energia Subcamadas s, p, d, f Nº de elétrons - Subcamadas s(2), p (6), d (10), f (14) * 2 elétrons em cada orbital Átomo de Bohr Diagrama de Linus Pauling Exercício Fazer a distribuição eletrônica utilizando os dados de número de elétrons em cada camada e em cada subcamada.
Baixar