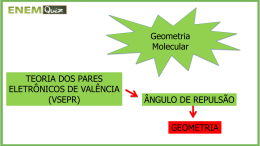
Ligação química II – geometria molecular Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Valence shell electron pair repulsion (VSEPR) Prediz a geometria de uma molécula com base na repulsão electrostática entre pares de electrões (ligantes e não ligantes). Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB2 2 0 linear linear B B Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Cloreto de Berílio Cl Be Cl 2 átomos ao átomo central partilhados no átomo central 0 pares e- não ligados Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB2 2 0 linear linear 0 planar trigonal planar trigonal AB3 3 Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Trifluoreto de Boro Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados AB2 2 0 AB3 3 0 AB4 4 0 Arranjo dos pares de e- Geometria molecular linear planar trigonal linear planar trigonal tetraedrica tetraedrica Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Metano Tetraedrica Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados AB2 2 0 AB3 3 0 AB4 4 0 tetraedrica tetraedrica 0 bipiramidal trigonal bipiramidal trigonal AB5 5 Arranjo dos pares de e- Geometria molecular linear planar trigonal linear planar trigonal Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Pentacloreto de Fósforo Bipiramidal Trigonal Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados AB2 2 0 AB3 3 0 AB4 4 0 tetraedrica tetraedrica bipiramidal trigonal octaédrica Arranjo dos pares de e- Geometria molecular linear planar trigonal linear planar trigonal AB5 5 0 bipiramidal trigonal AB6 6 0 octaédrica Ligação química II – geometria molecular Teoria da repulsão electrónica dos pares de e- da camada de valência Hexafluoreto de Enxofre Octaédrica Ligação química II – geometria molecular TRPECV Ligação química II – geometria molecular TRPECV par não partilhado vs. Tipo par não partilhado repulsão > par não partilhado vs. par ligante > par ligante vs. par ligante Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados AB3 3 0 AB2E 2 1 Arranjo dos pares de e- Geometria molecular trigonal planar trigonal planar trigonal planar não linear Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- AB4 4 0 tetraedrica tetraedrica 1 tetraedrica piramidal trigonal AB3E 3 Geometria molecular Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- AB4 4 0 tetraedrica tetraedrica piramidal trigonal dobrada AB3E 3 1 tetraedrica AB2E2 2 2 tetraedrica Geometria molecular O H H Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB5 5 0 bipiramidal trigonal bipiramidal trigonal 1 bipiramidal trigonal tetraedro distorcido AB4E 4 Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB5 5 0 bipiramidal trigonal bipiramidal trigonal 1 bipiramidal trigonal tetraedro distorcido 2 bipiramidal trigonal Forma -T AB4E AB3E2 4 3 F F Cl F Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados AB5 5 0 AB4E 4 1 AB3E2 3 2 AB2E3 2 3 Arranjo dos pares de e- Geometria molecular bipiramidal trigonal bipiramidal trigonal bipiramidal trigonal bipiramidal trigonal bipiramidal trigonal tetraedro distorcido Forma -T linear I I I Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB6 6 0 octaédrico octaédrico 1 octaédrico piramidal quadrangular AB5E 5 F F F Br F F Ligação química II – geometria molecular TRPECV Classe # de átomos ligados ao átomo central # pares de enão partilhados Arranjo dos pares de e- Geometria molecular AB6 6 0 octaédrico octaédrico 1 octaédrico piramidal quadrangular 2 octaédrico quadrangular planar AB5E AB4E2 5 4 F F Xe F F 10.1 Ligação química II – geometria molecular Prever a geometria molecular 1. Desenhe a estrutura de Lewis da molécula 2. Conte o nº de pares de e- não partilhados no átomo central e o nº de átomos ligados ao átomo central. 3. Utilize a TRPECV para prever a geometria da molécula. Qual a geometria molecular do SO2 e do SF4? O S F O AB2E não linear F S F AB4E F tetraedro distorcido Ligação química II – geometria molecular Momentos dipolares e moléculas polares baixa densidade electrónica µ=Qxr alta densidade electrónica H F δ+ δ− Q é a carga r é a distância entre cargas 1 D = 3.36 x 10-30 C m Ligação química II – geometria molecular Comportamento das moléculas polares Ligação química II – geometria molecular Momentos dipolares e moléculas polares Momento dipolar resultante = 1.46 D Momento dipolar resultante = 0.24 D Ligação química II – geometria molecular Momentos dipolares e moléculas polares Quais das seguintes moléculas possuem um momento dipolar ? H2O, CO2, SO2, e CH4 O H S H tem momento dipolar molécula polar O C O não tem momento dipolar molécula não polar O O tem momento dipolar molécula polar H H C H H não tem dipolar momento molécula não polar Ligação química II – geometria molecular Momentos dipolares e moléculas polares O CH2Cl2 tem um momento dipolar? Ligação química II – geometria molecular Momentos dipolares e moléculas polares Ligação química II – hibridação Teoria das orbitais de valência Como é que a teoria de Lewis explica as ligações em H2 e F2? Através da partilha de dois electrões entre dois átomos. Energia de Dissociação comprimento ligação Sobreposição de H2 436.4 kJ/mol 74 pm 2 1s F2 150.6 kJ/mol 142 pm 2 2p Teoria das orbitais de valência – as ligações são formadas pela partilha de electrões através da sobreposição de orbitais atómicas. Ligação química II – hibridação Teoria das orbitais de valência Variação da energia potencial de dois átomos de H Ligação química II – hibridação Teoria das orbitais de valência Variação da densidade electrónica Com a aproximação de dois átomos de H Ligação química II – hibridação Teoria das orbitais de valência Teoria das orbitais de valência e NH3 N – 1s22s22p3 3 H – 1s1 Se as ligações se formam pela sobreposição de 3 orbitais 2p do azoto com a orbital 1s de cada átomo de hidrogénio, qual será a geometria molecular do NH3? As 3 orbitais 2p preveêm 900 O ângulo actual H-N-H é de 107.30 Ligação química II – hibridação Hibridação Hibridação – mistura de duas ou mais orbitais atómicas para formar uma nova série de orbitais hibridas. 1. Misture pelo menos 2 orbitais atómicas não equivalentes (ex. s e p). As orbitais híbridas têm formas muito distintas das orbitais originais. 2. O numero de orbitais híbridas é igual ao número de orbitais atómicas puras utilizadas no processo de hibridação. 3. As ligações covalentes são formadas por: a. Sobreposição de orbitais híbridas com orbitais atómicas. b. Sobreposição de orbitais híbridas com outras orbitais híbridas. Ligação química II – hibridação Hibridação Formação de orbitais híbridas sp3 Hibridação Ligação química II – hibridação Hibridação Formação de ligações covalentes Ligação química II – hibridação Hibridação Hibridação sp3 do átomo de N em NH3 Prevê ângulo de ligação correcto Ligação química II – hibridação Hibridação Formação de orbitais híbridas sp Ligação química II – hibridação Hibridação Formação de orbitais híbridas sp2 Ligação química II – hibridação Hibridação Como prever a hibridação do átomo central? Conte o nº de pares de e- não partilhados E o nº de átomos ligados ao átomo central # pares não partilhados + # átomos ligados Hibridação 2 sp BeCl2 3 sp2 BF3 4 sp3 5 sp3d PCl5 6 sp3d2 SF6 Exemplos CH4, NH3, H2O Ligação química II – hibridação Hibridação Hibridação sp2 do átomo de carbono Ligação química II – hibridação Hibridação Orbital 2pz é perpendicular ao plano das orbitais híbridas Ligação química II – hibridação Hibridação Ligação no etileno Ligação sigma Pi (π) – densidade (σ) – densidade electrónica acima e entre osdodois abaixo plano dos átomos dos átomos núcleos da ligação Ligação química II – hibridação Hibridação Ligação química II – hibridação Hibridação Hibridação sp do átomo de carbono Ligação química II – hibridação Hibridação Ligação química II – hibridação Ligações sigma (σ) e ligações pi (π) Ligação simples 1 ligação sigma Ligação dupla 1 ligação sigma e 1 ligação pi Ligação tripla 1 ligação sigma e 2 ligações pi O Quantas ligações σ e π existem na molécula de ácido acético (vinagre) CH3COOH? H Ligações σ = 6 + 1 = 7 O H H C C Ligações π = 1 H Ligação química II – TOM Teoria das orbitais moleculares - TOM Experiências mostram que O2 é paramagnético O O nenhum edesemparelhado Devia ser diamagnético Teoria das orbitais moleculares – as ligações são formadas através da interacção de orbitais atómicas para formar orbitais moleculares. Ligação química II – TOM Teoria das orbitais moleculares Níveis de energia das orbitais moleculares ligante e não ligante para o hidrogénio (H2). Uma orbital molecular ligante tem menor energia e maior estabilidade que as orbitais moleculares que lhe deram origem. Uma orbital molecular antiligante tem maior energia e menor estabilidade que as orbitais atómicas a partir das quais foi formada. Ligação química II – TOM Teoria das orbitais moleculares Ligação química II – TOM Interacção entre 2 orbitais p e respectivas OM Ligação química II – TOM Moléculas diatómicas homonucleares – 2º período Li2, Be2, B2, C2 e N2 Ligação química II – TOM Configuração das Orbitais Moleculares 1. O número de orbitais molecular (OMs) formado é sempre igual ao número de orbitais atómicas combinadas. 2. Quanto mais estável for a OM ligante, menos estável será a correspondente OM anti-ligante. 3. O preenchimento das OMs é feito das orbitais de mais baixa energia para as de mais alta energia. 4. Cada OM pode acomodar até dois electrões. 5. A regra de Hund é utilizada quando se adicionam electrões a OMs com a mesma energia. 6. O número de electrões nas OMs é igual à soma de todos os electrões nas orbitais atómicas. Ligação química II – TOM Configuração das Orbitais Moleculares Ordem de ligação Ordem ligação 1 2 = ½ ( Nº de e- nas OMs ligantes 1 - ½ ) Nº de e- nas OMs não ligantes 0 Ligação química II – TOM Configuração das Orbitais Moleculares Ligação química II – TOM Orbitais Moleculares deslocalizadas Orbitais moleculares deslocalizadas não estão confinadas entre dois átomos adjacentes e estendem-se sobre 3 ou mais átomos. Ligação química II – TOM Orbitais Moleculares deslocalizadas A densidade electrónica na molécula benzeno. Ligação química II – TOM Orbitais Moleculares deslocalizadas A ligação na molécula de carbonato
Download