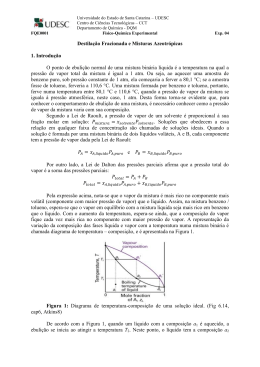
Misturas Azeotrópicas Existem muitos sistemas binários que apresentam desvios muito grandes à lei de Raoult–Soluções não ideais. Para soluções não ideais, as curvas de p.e apresentam máximos ou mínimos que correspondem, respectivamente, aos mínimos e aos máximos das curvas de pressão de vapor. A uma solução com composição correspondente a um máximo ou a um mínimo do diagrama de p.e. dá-se o nome de mistura azeotrópica ou azeótropo. Quando a mistura azeotrópica tem um desvio positivo à lei de Raoult o azeótropo ponto de ebulição mínimo. Quando a mistura azeotrópica tem um desvio negativo à lei de Raoult o azeótropo ponto de ebulição máximo. Desvio positivo à lei de Raoult Se a pressão total de vapor de uma mistura tiver um máximo para composições intermédias, o p.e. da mistura nessa composição será inferior ao dos seus componentes quando puros (ou a qualquer outra mistura) e o vapor terá a mesma composição que o líquido no estado de equilíbrio. Ex: Benzeno+Metanol, Etanol+Água. Desvio negativo à lei de Raoult Se a pressão total de vapor de uma mistura tiver um valor mínimo para composições intermédias, o p.e. da mistura nessa composição será superior ao dos seus componentes quando puros (ou a qualquer outra mistura) e o vapor terá a mesma composição que o líquido no estado de equilíbrio. Componentes puros aparecerão no destilado, e o azeótropo no frasco. Azeótropo máximo Componentes puros aparecerão no frasco, e o azeótropo no destilado. Azeótropo mínimo b = o vapor terá a mesma composição que o líquido, cuja a T=cte Equilíbrio Líquido-Vapor em Sistemas Azeotrópicos Realizando a destilação fracionada de um sistema de dois líquidos que formam uma mistura azeotrópica, a partir da construção de um diagrama de temperatura versus composição (diagrama líquido-vapor). Experimentalmente, isto foi feito (1) verificando-se a temperatura de ebulição da mistura com um termômetro em contato direto com o vapor e o líquido, e (2) determinando-se a composição do resíduo e do destilado por meio do índice de refração, o qual é função da concentração das substâncias. O par de líquidos utilizado foi acetona e clorofórmio. Dados experimentais: A partir de um aparelho de destilação simples, diversas amostras de destilado e de resíduo, com composições diferentes de acetona e clorofórmio, foram recolhidas para determinação de seus índices de refração. No total, analisou-se 8 (oito) alíquotas de destilado, incluindo de acetona pura (amostra n°1), e 7 (sete) porções de resíduo retiradas do balão de destilação. Além dos índices de refração, para cada amostra-problema anotou-se também a temperatura de ebulição da mistura binária. Embora se conheçam os volumes de clorofórmio adicionados em cada amostra numerada, a concentração relativa de CHCl3, em cada alíquota recolhida tanto de resíduo quanto de destilado, não é sabida. Para determinação, pois, desta concentração nas amostras-problema, primeiramente, construiu-se uma curva padrão a partir dos índices de refração da acetona pura e do clorofórmio puro. Como exibido na figura, a mistura apresenta um azeótropo de máximo na composição 70,2% molar de clorofórmio com temperatura de ebulição 63,62 °C.
Baixar