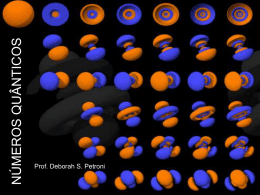
Material Complementar ORBITAIS ATÔMICOS Este texto oferece a oportunidade de conhecermos um pouco mais sobre a estrutura de um átomo. Algumas informações mostradas aqui estão simplificadas de forma que possamos entender parte dos conceitos que explicam o comportamento dos átomos e de suas partículas subatômicas, sobretudo os elétrons. Leia venha discutir o assunto nos plantões. Bom estudo. Os orbitas atômicos Define-se por orbital, uma região espacial (portanto em 3D) na qual a probabilidade de se encontrar um elétron é máxima. De forma simplificada, podemos entender que se existe um local que o elétron possa ocupar ao redor do núcleo, esse local é o orbital. O comportamento dos elementos químicos é quase que determinado pelos elétrons existentes em seus átomos, principalmente pelos elétrons que possuem maior número quântico principal (n), freqüentemente chamados de elétrons de valência. Os tipos de orbitais (s, p, d e f) e suas respectivas formas também são importantes. A seguir, vamos estudar esses orbitais com mais detalhes. Orbitais tipo s: Num átomo de hidrogênio temos um único elétron situado num subnível 1s. Logo, este elétron ocupa um orbital tipo s. Mas o que isso quer realemente dizer? Se pudéssemos observar este elétron e fotografá-lo em intervalos de centésimos de segundo, viríamos que uma seqüência de imagens mostrando várias posições deste elétron. A sobreposição destas imagens nos mostraria quais as posições deste elétron ao redor do núcleo, ou seja, qual a forma do orbital s. Veja a figura mostrada abaixo: REPRESETAÇÃO GEOMÉTRICA DO ORBITAL s Dizemos então que os orbitais s possuem forma esférica, independentemente do nível ao qual pertencem. Em outras palavras, não faz diferença se o orbital é 1s, 2s, 3s, 4s, 5s, 6s ou 7s, todos são esféricos e não direcionais. Orbitais tipo p: Os orbitais tipo p aparecem em elétrons com número quântico principal maior que 1, ou seja, apenas em elétrons acima da primeira camada, e possuem número quântico secundário 1. Todos apresentam a mesma forma geométrica mostrada abaixo: ATENÇÃO: Cada orbital possui uma região chamada plano nodal, que é definido como um plano que divido o orbital ao meio, no qual a probabilidade do elétron ser encontrado é nula. O núcleo do átomo está nesse plano. Observe uma coisa interessante. Existem 3 orientações possíveis para um orbital p, nos eixos x, y e z. Sendo assim podemos dizer que os orbitais tipo p podem ser pX, pY e pZ, conforme sua orientação nos eixos. Graficamente costumamos representar um subnível p por 3 quadrados indicando os orbitais. Os orbitais do tipo p são direcionais (se orientam de acordo com os eixos x, y e Z). Em resumo, o orbital p é formado por duas regiões interceptadas por um plano chamado de plano nodal. Orbitais tipo d: A representação gráfica dos orbitais tipo d sugere uma região espacial bem diferente (e mais complexa) do que as regiões dos orbitais s e p. As subcamadas d são formadas por cinco orbitais, representados por dxy , dyz , dxz , dx2 2 2 y e dz Cada orbital possui dois planos nodais, ou seja dois planos que dividem cada orbital. (lembre que os orbitais p apresentavam 1 plano nodal, e o orbital s sequer falamos desse plano nodal) Orbitais tipo f: Os orbitais do tipo f possuem formas variadas. Seu estudo torna-se importante apenas para os elementos do bloco f (transição interna da tabela periódica). Cada orbital f apresenta 3 planos nodais. Na figura abaixo mostramos seus desenhos: Cada orbital f apresenta 3 planos nodais. Agora temos um pouco mais de idéia sobre a forma e distribuiação de elétrons em orbitais. Mas, detalhando um pouquinho mais nosso estudo, vamos comprovar outro fato interessante. Existe uma relação importantíssima entre o número secundário (aquele que representa o tipo de subnível) e o número de planos nodais dos orbitais. Como assim? (você deve estar se perguntando) Observe: NÚMERO QUANTIDADE DE TIPO DE QUÂNTICO PLANOS NODAIS SUBNÍVEL SECUNDÁRIO (L) EM 1 ORBITAL s 0 0 p 1 1 d 2 2 f 3 3 Podemos entender a razão pela qual os números quânticos secundários dos subníveis s, p, d e f são exatamente 0,1,2 ou 3. Um estudo mais aprofundado sempre nos oferece mais ferramentas para compreendermos aquilo que parece incompreensível não é mesmo?
Baixar