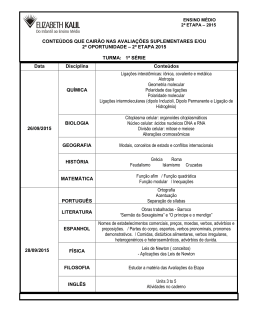
PROGRAMAÇÃO DA 2ª ETAPA MATÉRIA: Química SÉRIE: 1ª - Ensino Médio PROFESSOR: Marcus Reis “A PERFEITA HUMILDADE ARRASTA AO AMOR DE DEUS.” Sto. Agostinho CONTEÚDOS: • Capítulo 12 - Propriedades Periódicas dos elementos • Conceito de propriedade periódica. • Valência. • Raio atômico. • Energia de ionização. • Afinidade eletrônica. • Eletronegatividade. • Ponto de fusão, ponto de ebulição e densidade. • Capítulos 13, 14 e 15 - Ligações Químicas interatômicas: Covalente, iônica e metálica. • Gases nobres e a regra do octeto. • Propriedades de Metais e de Ametais. • Ligações interatômicas e suas propriedades: formação da ligação, características da ligação, condutividade elétrica, ponto de fusão, ponto de ebulição e estado físico. • Capítulo 16 - Geometria Molecular • Capítulo 17 - Polaridade de ligações e de moléculas • Polaridade de ligações. • A relação entre eletronegatividade e polaridade de moléculas. • Polaridade e solubilidade. • Capítulo 18 - Ligações intermoleculares. • Ligações dipolo permanente-dipolo permanente. • Ligações dipolo instantâneo-dipolo induzido. • Ligações de Hidrogênio. • Capítulo 19 – Alotropia. • Conceito de Alotropia. • Principais exemplos (oxigênio e ozônio; fósforo branco e vermelho; grafite e diamante, entre outros). • Capítulo 20 – Condutividade elétrica de soluções aquosas. • Dissociação iônica e ionização. • Soluções eletrolíticas e não-eletrolíticas. • Capítulos 21, 22 e 24 – Ácidos, Bases (Hidróxidos), Sais e Óxidos. • Substâncias orgânicas e inorgânicas. • Conceituação, fórmulas e nomenclatura das principais funções inorgânicas. • Reações de neutralização. • Óxidos e a poluição atmosférica. HABILIDADES: • Compreender a tabela periódica e as propriedades relativas à sua estrutura: valência, raio atômico, eletronegatividade, energia de ionização, afinidade eletrônica, ponto de fusão e de ebulição e densidade. • Conhecer e diferenciar as ligações químicas interatômicas e suas propriedades. • Compreender e esboçar desenhos de moléculas com relação à sua geometria. Estabelecer a polaridade das moléculas em função de sua geometria e simetria. PE 072-2012 1 • • • • • • • • • Conhecer e diferenciar as ligações intermoleculares. Relacionar as ligações com a solubilidade e o ponto de ebulição de substâncias. Conhecer e analisar os compostos orgânicos mais comuns. Interpretar as propriedades das várias substâncias moleculares, a partir da análise das ligações intermoleculares do tipo Dipolo instantâneo/induzido, Dipolo-dipolo e Ligações de Hidrogênio. Conceituar e exemplificar Alotropia. Entender dissociação iônica e ionização e relacionar com o tipo de ligação estabelecida. Identificar e conhecer as principais características das funções inorgânicas mais comuns, tais como óxido, hidróxido, ácido e sal. Caracterizar as funções inorgânicas, a partir da nomenclatura dos compostos. Calcular o número ou estado de oxidação dos elementos dentro dos compostos mais conhecidos e utilizar este número para dar nomes aos compostos inorgânicos mais comuns, segundo a nomenclatura oficial da IUPAC. Conhecer alguns compostos inorgânicos comuns e estabelecer sua principal utilidade no cotidiano. DISTRIBUIÇÃO DE PONTOS: • Provas: 20,0 • Simulado: 6,0 • Laboratório (relatórios): 4,0 pontos. DICAS DE APROFUNDAMENTO: Informe-se sobre a Química – textos complementares ao final de cada capítulo do livro didático adotado. • http://dicasdequimica.vila.bol.com.br • http://educar.sc.usp.br • http://sbqensino.foco.fae.ufmg.br PE 072-2012 2
Baixar