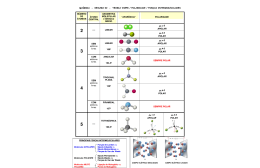
LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons na camada K). Todos os outros elementos químicos adquirem a estabilidade por meio de ligações entre os átomos. TEORIA DO OCTETO – adquirir configuração estável, geralmente com 8 elétrons na última camada (camada de valência). Temos portanto 3 tipos de ligações químicas: Ligação iônica – metal + não metal Ligação covalente - não metal + não metal Ligação metálica - metal + metal. Ligação iônica = transfere elétrons (um doa – outro recebe) Metal 1, 2, 3 e- c.v. Doar eÍon+ Cátion Exemplo: Átomo de sódio Não metal 5, 6, 7 e- c.v. Receber eÍon Ânion Átomo de Cloro Na+ → Cl- : NaCl DETERMINAÇÃO DAS FORMULAS DO COMPOSTO IÔNICO CARACTERÍSTICAS DOS COMPOSTOS IÔNICOS Os íons se unem devido às forças de atração eletrostática, que ocorrem em todo o espaço ao seu redor. Essa atração produz aglomerados com formas geométricas bem definidas, denominados retículos cristalinos. (Exemplo – Cloreto de Sódio = Sal de Cozinha) Principais características: a) são sólidos nas condições ambientes (25ºC, 1 atm); b) apresentam elevado ponto de fusão e de ebulição; c) são duros e quebradiços; d) conduzem corrente elétrica quando dissolvidos em água ou quando puros no estado líquido (fundidos). Ligação Covalente = compartilha elétrons (ambos recebem) H → 1eNão metais – 4, 5, 6, ou 7 e- na c.v. Representação da fórmula estrutural LIGAÇAO COVALENTE DATIVA OU COORDENADA Ligação semelhante à covalente comum e ocorre entre um átomo que já atingiu a estabilidade eletrônica e outro ou outros que necessitem de dois elétrons para completar sua camada de valência. LIGAÇÃO METÁLICA – ocorre entre metais. Metais formam sólidos cristalinos, contêm elétrons frouxamente ligados (elétrons livres = mar de elétrons), isso explica a grande capacidade de conduzir corrente elétrica. Algumas ligas importantes Latão – liga de cobre e zinco. Bronze – liga de cobre e estanho. Aço – liga de ferro e carbono (apesar de este não ser metal). Ouro 18 quilates (18K) – é uma liga que tem 75% de ouro e 25% de prata e/ou cobre. (Ouro puro – 24k) Aço inoxidável – liga de ferro, carbono, níquel e cromo. POLARIDADE DE LIGAÇÕES E MOLÉCULAS A ligação covalente pode ser classificada em: polar e apolar. 1) Eletronegatividade: é a força de atração exercida sobre os elétrons de uma ligação. 2) Pólo: região com acúmulo de cargas elétricas. Positivo Negativo LIGAÇÕES APOLARES: quando uma ligação feita entre átomos de mesma eletronegatividade. Exemplo: * Toda substância simples são consideradas apolares. Exemplos: O2; H2; Cl2; P4, etc LIGAÇÕES POLARES: quando apresenta eletronegatividade diferente, ou seja, ocorre acúmulo de carga negativa no elemento com maior eletronegatividade. Exemplo: * Toda ligação iônica é polar. (forma cátion + e ânion -) Para determinar a polaridade das moléculas comparamos o número de ―nuvens eletrônicas‖ ao redor do átomo central com o número de grupos ligantes. Número de nuvens eletrônicas ao = Número de átomos APOLAR redor do átomo central (igual) ligados ao central Número de nuvens eletrônicas ao ≠ Número de átomos POLAR redor do átomo central (diferente) ligados ao central EXERCÍCIOS 1) Escreva as fórmulas eletrônica e estrutural da água (H2O) e da água oxigenada (H2O2). 2) Considere as informações: Elemento Família N VA C IV A O VI A F VII A Represente as fórmulas eletrônicas e estruturais das seguintes substâncias. a) NF3 b) CH4 c) CO2 3) Em qual substância simples existe uma tripla ligação? a) H2 b) Cl2 c) O2 d) N2 e) F2 4) Escreva as fórmulas eletrônicas e estruturais dos compostos: a) O3 b) CO 5) Um dos principais poluentes atmosféricos é o dióxido de enxofre (SO2). Em uma molécula de SO2 podemos afirmar que o número total de elétrons existentes e o número total de elétrons compartilhados são, respectivamente, iguais a: Dados (números atômicos: O = 8; S = 16) a) 32 e 6 b) 32 e 4 c) 18 e 6 d) 18 e 4 e) 12 e 3 6) Indique o tipo de ligação presente em cada substância: I — CaO II — CO2 III — Fe(s) IV — Hg(l) V — Cu(s) 7) Faça a associação correta: I — Au II — Cu III — Hg IV — W V — Fe a) ( ) metal líquido a 25ºC a 1atm. b) ( ) metal de cor amarela. c) ( ) fabricação de trilhos. d) ( ) filamento de lâmpada incandescente. e) ( ) presente nas ligas: bronze e latão. 8) (VUNESP) Dentre as moléculas H2S, CO2, PCl3, BCl3, Br2 e CCl4,são polares: a) CO2 e BCl3 b) BCl3 e CCl4 c) CO2 e Br2 d) H2S e PCl3 e) apenas H2S 9) (UFSM-RS) Assinale a alternativa que caracteriza, respectivamente, a polaridade das substâncias dióxido de carbono, metano e tetrafluormetano. a) apolar — apolar — apolar. b) apolar — apolar — polar. c) polar — apolar — polar. d) polar — polar — polar. e) apolar — polar — polar. 10) (MACK-SP) Dentre as substâncias água, cloreto de hidrogênio, tetracloreto de carbono e gás carbônico, é correto afirmar que: Dados: H(1A); C(4A); Cl(7A); O(6A) a) todas são moléculas polares. b) somente o gás carbônico e tetracloreto de carbono são moléculas polares. c) somente a água e o cloreto de hidrogênio são moléculas polares. d) somente o cloreto de hidrogênio e o tetracloreto de carbono são moléculas polares. e) somente o tetracloreto de carbono e a água são moléculas polares. 11) (UEL-PR) No gelo seco, as moléculas do dióxido de carbono estão unidas por a) pontes de hidrogênio. b) forças de Van der Waals. c) ligações covalentes. d) ligações iônicas. e) ligações metálicas. 12) O modelo microscópico de um composto iônico no estado sólido é denominado retículo cristalino iônico. Faça o desenho de um retículo constituído de oito cátions e oito ânions. 13)Considere os íons: ânions: Fluoreto (F –); óxido (O2–) Cátions: sódio; cálcio e alumínio. Escreva a fórmula dos compostos resultantes da combinação dos íons. 14) Qual dos compostos abaixo apresenta as seguintes características: — sólido cristalino à temperatura ambiente; — PF e PE elevados; — condutividade elétrica quando fundido ou em solução aquosa. a) CO2 b) SO2 c) H2S d) CaO e) C6H12O6
Download