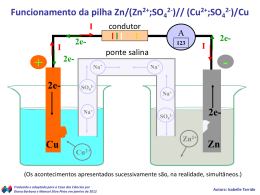
UNIVERSIDADE FEDERAL RURAL DO RIO DE JANEIRO CONCURSO PARA REINGRESSO E TRANSFERÊNCIA 2011/2012 GABARITO QUÍMICA Questão 1 12g ----- 390 kJ 1000g ---- x x = 32500 kJ 32500 kJ ------ 100 % z ------------ 10% z = 3250 kJ Calor obtido = 32500 – 3250 = 29250 kJ/mol Questão 2 a) b) 8g 0,1 x 10 = Cf x 1000 → 0, 001mol/L Questão 3 a) Ester, éter, amina e amida. b) 4 carbonos com hibridação sp3. Questão 4 a) Linear angular trigonal plana b) HNO3 ácido nítrico Questão 5 a) A reação representada é exotérmica. Pois a variação de entalpia dos produtos e menor que do reagente. b) A curva B representa o caminho da reação na presença de catalisador, pois se observa um decréscimo na energia de ativação. Questão 6 a) Não. A massa no experimento II não é conservada porque há formação de CO 2 que é um gás. Logo a massa do produto será menor. Já no experimento I a massa é conservada b) AgCl cloreto de prata Questão 7 a) Os compostos B e D são isômeros de função. b) Os compostos E e C por oxidação dão respectivamente A e F. Questão 8 a) A lâmpada acende nos frascos B, D e F,porque apresentam eletrólitos em solução. b) A não evidência de condutividade elétrica no frasco que contém o NaCl é que no estado sólido o composto iônico não apresenta os eletrólitos. Ele só iria conduzir a eletricidade no estado fundido ou em solução. Questão 9 a) No experimento B, a constante tem maior valor, pois a reação está deslocada no sentido direto (direita). b) A reação direta é endotérmica, pois o resfriamento favorece a reação exotérmica. Questão 10 a) SnCl2 H2O Sn+2 + 2ClH+ + OH- (C-) Sn+2 + 2e- Snº (A+) 2Cl- Cl2 + 2eSn+2 + 2Cl- Snº + Cl2 + H2O O gás em questão foi o Cl2 produzido no anôdo b) Sn+2 + 2e- Snº 2x96500 119g 57900 x Q=it Q=12x4825 X= 35,7g (massa de Sn depositada no cátodo) Ou m=Eit/96500 m=119x12x4825 2x96500 Q=57900C m=35,7g
Baixar