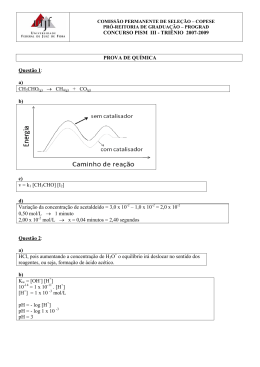
TAREFA DA SEMANA DE 28 DE ABRIL A 02 DE MAIO QUÍMICA – 3ª SÉRIE 1. (Ita) Considere a reação química representada pela seguinte equação: 4NO2 (g) + O2(g) 2N2O5(g) Num determinado instante de tempo t da reação, verifica-se que o oxigênio está sendo consumido a uma velocidade de 2,4 × 10-2 molL-1s-1. Nesse tempo t, a velo cidade de consumo de NO2 será de a) 6,0 × 10-3 molL-1s-1. b) 1,2 × 10-2 molL-1s-1. c) 2,4 × 10-2 molL-1s-1 . d) 4,8 × 10-2 molL-1s-1. e) 9,6 × 10-2 molL-1s-1. 2. (Pucmg) Considere a seguir o diagrama energético de uma reação: O valor representado por A corresponde: a) à energia de ativação da reação. b) à entalpia da reação. c) à entropia da reação. d) à velocidade da reação. 3. (Pucpr) Os chamados vinhos de novas latitudes, como, por exemplo, os vinhos brasileiros produzidos no Nordeste, têm obtido destaque segundo a opinião de especialistas do mundo todo. Uma classe de compostos bastante interessante e comumente encontrada nos vinhos (em especial nos tintos) é a chamada polifenóis. Dentre várias substâncias dessa classe, pode-se destacar o resveratrol, uma fitoalexina (antibiótico sintetizado por vegetais) que aparentemente mimetiza diversos efeitos bioquímicos da restrição calórica. A velocidade de sua decomposição no organismo humano pode ser expressa pela equação: V = [res]2 / pH em que [res] corresponde à concentração de resveratrol (mol L-1). Assim, pode-se AFIRMAR que, quanto mais básico for o meio, a) Ocorre a aceleração de sua decomposição. b) Menor será a quantidade de resveratrol decomposto por unidade de tempo. c) Maior será a produção de vinho. d) Será menor a ação antibiótica do resveratrol. e) Maior o consumo de vinho. 4. (Ufrgs) A figura a seguir representa o esquema energético de uma reação genérica reversível, processo simples realizado em uma única etapa e que pode ocorrer sem catálise (linha cheia) ou com catálise (linha tracejada). Sobre essa reação, são feitas as seguintes afirmações. I - A reação direta é endotérmica. II - A reação inversa é mais rápida na presença de catalisador. III - O rendimento da reação direta é aumentado com o uso do catalisador. Quais estão corretas? a) Apenas I. b) Apenas II. c) Apenas I e II. d) Apenas II e III. e) I, II e III. 5. (G1 - utfpr) Observe a propaganda desse medicamento: "O nosso produto é o primeiro analgésico de paracetamol em comprimidos efervescentes no Brasil. É absorvido duas vezes mais rápido pelo organismo". Se ele é absorvido duas vezes mais rápido, isso implica que a velocidade da reação do princípio ativo é maior do que quando se utiliza um comprimido não efervescente. Isso está relacionado a qual fator de influência da velocidade de reação? a) Temperatura. b) Catalisador. c) Luz. d) Estado físico dos reagentes. e) Superfície de contato. 6. (Ufrgs) A reação NO2(g) + CO(g) CO2(g) + NO(g) possui uma lei cinética v = k[NO2]2. Considere o quadro a seguir, que apresenta os dados relativos a situações experimentais com essa reação. Velocidade [NO2] inicial [CO] inicial mol/L mol/L 1 0,01 0,02 0,001 2 0,02 0,01 v2 Experimento inicial mol.L-1.min-1 A análise desses dados permite determinar que a constante de velocidade k, em L mol-1 min-1, e a velocidade v2, em mol L-1 min-1, são, respectivamente, a) 0,1 e 0,001. b) 0,1 e 0,002. c) 0,1 e 0,004. d) 10 e 0,002. e) 10 e 0,004. 7. (Uece) A ação anestésica do clorofórmio (CHCℓ3) dá-se por esse ser muito volátil. Dessa forma, ele absorve calor da pele, a qual tem temperatura diminuída, então os nervos sensitivos, que mandam as informações ao cérebro, ficam inativos e a sensação de dor e diminuída. A tabela a seguir apresenta os dados de três experimentos da reação química dada por: CHCℓ3(g) + Cℓ2(g) CCℓ4(g) + HCℓ(g). Usando esses dados, assinale o correto. a) A lei da velocidade é: v = k[CHCℓ3][Cℓ2]. b) A reação é de segunda ordem em relação ao clorofórmio. c) O valor da constante de velocidade é k = 5 × 103 (mol/L)-1/2 s-1. 3 d) A reação é de ordem três meios em relação ao cloro. 2 8. (Pucrj) Considere a reação de decomposição do aldeído acético, CH3CHO, indicada a seguir: CH3CHO(g) CH4(g) + CO(g) A lei de velocidade da reação, a uma temperatura definida, é: v = 0,045[CH3CHO]2 onde 0,045 é a constante de velocidade. Assinale a alternativa a seguir que indica a razão v1/v2, onde v1 é a velocidade de reação quando a concentração inicial de CH3CHO for 0,050 mo L-1 e v2 é a velocidade de reação quando a concentração inicial de CH3CHO for 0,025 mo L-1. a) 1 b) 2 c) 2,5 d) 4 e) Zero
Baixar
![01) [2,0 pontos] A velocidade da reação: Mg(s) + PbCl2(aq](http://s1.livrozilla.com/store/data/001720061_1-a33d12dc3f218f2ffa5c5a4203a97ed3-260x520.png)

![[2,0 pontos] O gráfico abaixo refere](http://s1.livrozilla.com/store/data/000905646_1-195eb4a910ccbf5921989706f9439278-260x520.png)







