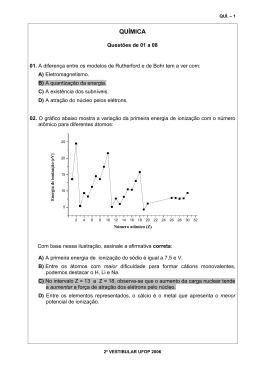
Exercícios de fixação 02 1 - 0,200g de cloreto de potássio (KCl) foram utilizados para preparar 250 mL de solução aquosa. a - Escreva a equação química iônica (balanceada) da dissolução do KCl em água. b - Qual a concentração molar (mol L-1) do cloreto de potássio? c - Quais as concentrações molares dos íons K+ e Cl-? 2 - Um químico precisa preparar uma solução aquosa 0,0500 mol L-1 de HCl (ácido clorídrico). Para isso ele tem disponível um frasco de HCl concentrado (ainda fechado), com as seguintes propriedades: ρ = 1,20 g mL-1 e τ = 37%. a - Qual o volume em mL necessário para preparar 500 mL de uma solução aquosa 0,0500 mol L-1 de HCl. b - Qual o volume em mL ou µL necessário para preparar 100 mL de uma solução aquosa 5,00×10-5 mol L-1 de HCl a partir da solução preparada no item a. 3 - 250,0 mL de uma solução aquosa 5,00×10-2 mol L-1 de NaOH foi misturada com 750,0 mL de uma solução aquosa 2,00×10-2 mol L-1 de KOH. Diante as informações pede-se: a - Qual a concentração de NaOH na mistura? b - Qual a concentração de KOH na mistura? c - Qual a concentração dos íons sódio, potássio e hidróxido na solução? 4 - O composto XCl2(NH3)2 forma-se da reação entre XCl4 e NH3. A. Suponha que 3,571 g de XCl4 reagem com excesso de NH3 para dar Cl2 e 3,180 g de XCl2(NH3)2. Qual é o composto X? B. Qual a massa necessária de XCl4 para preparar 250,0 mL de uma solução 5,00 × 10-3 mol L-1? Equações: = ; =
Baixar