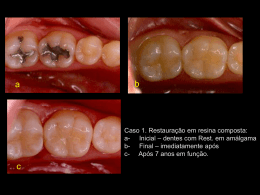
Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil Reação citoquímica com AgNO2 A coloração com nitrato de prata é um processo citoquímico de oxidação/redução empregado em diversas metodologias, como por exemplo, na detecção de proteínas e DNA em géis de poliacrilamida e ribonucleoproteínas em preparações citogenéticas e citológicas (ML e MET). Esta coloração é ainda hoje muito usada na citogenética para localização nucléolos e regiões organizadoras de nucléolos em animais e plantas, mas este uso começou a perder espaço depois da disseminação da FISH com sondas de DNAr, já que a técnica da Ag-NOR revela somente sítios funcionais enquanto que a FISH revela os sítios que contém os genes para as ribonucleoproteínas, independente de serem funcionais ou não. Contudo, a impregnação com AgNO3 pode ser utilizada em associação com técnicas de citologia em microscopia de luz e eletrônica de transmissão para estudar outros componentes celulares, como por exemplo, cinetócoros, Complexo de Golgi, ou mesmo de modo mais amplo a androsporogênese, já que como não ocorre impregnação na exina e calose, todo o conteúdo interno do esporo fica facilmente contrastado. A coloração com AgNO3 pode ainda ser usada em estudos de marcadores moleculares, já que o refinamento da coloração é capaz de revelar e definir bandas dificilmente visíveis com corantes fluorescentes, sobretudo em géis de poliacrilamida. Este método citoquímico é de uso amplo, baixo custo e vale a pena ser implantado nos laboratórios para estudos citológicos, citogenéticos e citomoleculares. A idéia aqui é mostrar alguns detalhes do uso do AgNO3 e ampliar a capacidade de trabalho, possibilitando o emprego de diferentes procedimentos em um tema. Coloração de lâminas e/ou tecidos (vegetal ou animal) Existem diferentes técnicas, com diferentes macetes, para usar AgNO 3 no estudo de núcleos e cromossomos. Em geral, a solução de AgNO3 é preparada em concentração elevada (cerca de 50%) em água ou tampão, e aplicada diretamente sobre a lâmina. Os diferentes procedimentos tentam sempre provocar uma oxidação direcionada para as proteínas argentófilas encontradas nos nucléolos e RONs, evitando ao máximo a precipitação do oxidado em locais inespecíficos, pois esses podem deixar as amostras com uma qualidade ruim para a análise. Alguns protocolos empregam meio com gelatina, outros usam tela de nylon e outros a coloração prévia do material biológico antes da impregnação com de AgNO3. Nesses três exemplos, o precipitado ficaria preso à malha da gelatina ou do Nylon, ou ainda fora da raiz. De fato, todos funcionam e o sucesso depende muito mais da experiência de cada um, bem como dos cuidados na manipulação e das condições laboratoriais. Passaremos agora para três protocolos que têm funcionado bem em nosso laboratório, e que além da citogenética, podem ser usados para a microscopia eletrônica de transmissão. Coleta e Fixação do Material Amostras podem ser coletadas e diretamente fixadas, ou pré-tratadas com o agente antimitótico mais adequado para cada material. Os fixadores podem variar de acordo com os materiais e objetivos da técnica. Tecidos animais são em geral fixados em metanol: ácido acético (3:1, v:v). Tecidos vegetais são em geral fixados em etanol: ácido acético (3:1, v:v). Mas uma combinação de fixadores, com adição de clorofórmio, ou formaldeído também funcionam. Os fixadores do tipo aldeídos preservam melhor as proteínas e oferecem um resultado melhor na coloração, contudo, os materiais ficam muito duros para as preparações citogenéticas, sobretudo Página 1 de 1 Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil em plantas. Mas se o objetivo for corte histológico (semi-fino ou ultrafino), é aconselhável fazer fixações com um pouco de formaldeído e glutaraldeído (com proporções abaixo de 3%). Preparo da solução de AgNO3 1- Pese 0,5 g de AgNO3 e dissolva em 1 mL de água MilliQ, em frasco protegido da luz; 2- Filtre a solução em filtro de papel ou membrana e estoque na geladeira, também em frasco protegido da luz; 3- Se a solução ficar estocada por mais de uma semana, filtre sempre antes do uso. Preparo da solução de gelatina 1. Pese 0,2 g de gelatina natural e incolor (a mais natural que encontrar) e dissolva em 10 mL de água MilliQ; 2. Após a total dissolução, acrescente 100 microlitros de ácido fórmico e homogeneíze muito bem a solução; 3. Estoque em frasco escuro na geladeira. Coloração na lâmina 1. Lave as raízes (previamente pré-tratadas e fixadas) em água destilada, pelo menos dois banhos de 5 minutos cada; 2. Trate das raízes com uma solução de celulase e pectinase (preparada em água destilada), à 37 C, até que o tecido fique bem mole; 3. Prepare as lâminas por dissecção em ácido acético 45%, retirar as lamínulas por congelamento e deixe-as secar brevemente; 4. Antes de começar a coloração, proteja a bancada com papel, use luvas, e tome todos os cuidados possível para não deixar cair, gotejar ou escorrer AgNO3; A sujeira será irreversível; 5. Pingue sobre o material 1 a 2 gotas de solução de gelatina, dependendo do tamanho da lamínula; 6. Adicione 2 (duas) gotas da solução de AgNO3 a 50%, previamente filtrada, para cada gota de gelatina; 7. Cubra com lamínula de vidro e incube a 60 C em câmara úmida; 8. Monitore a coloração observando a oxidação a olho nu, bem como em microscópio de luz (busque pelos nucléolos). Tome muito cuidado ao manipular a lâmina com AgNO3 no microscópio e estufa, pois este irá impregnar em tudo; 9. Note que cada amostra poderá ter um tempo diferente de coloração, assim, faça a coloração caso a caso, lâmina por lâmina; 10. Após o tempo apropriado, quando os cromossomos assumirem uma tonalidade amarelada e as RONs e os nucléolos uma coloração preta ou marrom, lave as lâminas em água destilada, deixando que a lamínula seja retirada pela própria água; 11. Cheque a coloração. Para tal, monte com lamínula e água e observe usando a objetiva de 40; 12. Remova a lamínula com um jato leve de água destilada, acima do material; 13. Caso a coloração esteja um pouco fraca, esta poderá ser reforçada com Giemsa 1% (30 segundos a 1 minuto); Página 2 de 1 Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil 14. Lave a lâmina com um jato de água destilada com um jato de água destilada, acima do material, seque com bomba de ar e monte a lâmina permanete. OBSERVAÇÕES Exceto pelo modo de preparo das lâminas, esta coloração servirá para cromossomos de animais ou plantas; Caso a opção seja por substituir a gelatina por Nylon, aloque a tela de Nylon (cortado do tamanho de uma lamínula) sobre o material e pingue diretamente duas gotas da solução de AgNO3 em cima do Nylon. Movimente a tela com uma pinça para que o AgNO3 alcance o material. Neste caso, será mais difícil checar a coloração. Coloração do tecido e posterior preparo das lâminas 1. Lave as raízes (previamente pré-tratadas e fixadas) em água destilada, pelo menos dois banhos de 5 minutos cada; 2. Coloque 300 microlitros da solução de AgNO3 a 50%, previamente filtrado, em um microtubo, envolto por papel alumínio, e mergulhe o material (raízes, anteras, grãos de pólen ou qualquer tecido) nesta solução. Vede bem o microtubo e coloque-o em uma estufa à 60 C e deixe por 12 horas; 3. Após o tratamento, lave as raízes ou tecidos 10 vezes em água destilada (5 minutos cada) e mantenha em água até o processamento do material; apreparo de lâminas para a citogenética como descrito acima, mas note que as raízes já estão impregnadas pela prata, assim, ao terminar o preparo, cheque a coloração, veja se será necessário ressaltar com Giemsa e monte-a permanente. bpreparo de blocos para cortes o Em seguida, o material deve ser desidratado em série alcoólica (70%, 80%, 90% e 100%) em três banhos de 10 minutos cada. o Inicie o processo de embebição do material a ser diafanizado em um solvente de resina plástica (acetona 100%, Acetonitrila ou Oxido de propileno) em três banhos de uma hora cada. No caso de se usar a acetona como solvente da resina, é aconselhável desidratar o material em série crescente de acetona ao invés do etanol. A embebição pode ser feita em qualquer tipo de resina plástica (Araldite, Resinas do tipo epon e Spurr). Em se tratando de material vegetal os banhos de embebição devem ser de 24 horas no mínimo, no caso de material de natureza animal ou suspensão de células este tempo pode ser reduzido a 6 horas, no entanto em ambos os casos a agitação deve ser constante. A embebição deve ser feita se aumentando a concentração da resina de forma gradual como a seguir: Resina: solvente (1:2) Resina: solvente (1:1) Resina: solvente (2:1) Resina pura. o Após a embebição, o último banho de resina pura deve ser trocada, os blocos montados e a resina deve ser polimerizada em estufa 70 C por 24 a 48 horas. Faça os cortes com navalha de vidro, com 2 micrometros de espessura. Transfira estes para uma gota de água em uma lâmina de vidro e coloque-a Página 3 de 1 Laboratório de Citogenética e Diversidade Vegetal Departamento de Biologia Geral, CCB, Universidade Estadual de Londrina Tel: 43 3371 4509 – Fax: 43 3371-4417 - Campus Universitário Caixa Postal 6001, CEP: 86.051-990 – Londrina – Paraná - Brasil em uma chapa pré-aquecida. ao terminar o preparo, cheque a coloração, veja se será necessário ressaltar com Giemsa e monte-a permanente. Coloração de géis Há basicamente duas estratégias de coloração de géis de poliacrilamida. Uma usa solução de AgNO3 em diamina ou amoníaco para impregnar o gel, seguida de diluição ou lavagem em solução ácida contendo formaldeído. Na segunda maneira de corar as proteínas, uma solução de nitrato de prata em meio levemente ácido é usada para impregnar o gel e, na sequência, a prata é reduzida em solução alcalina na presença de formaldeído. Em ambos os métodos, o sal é reduzido em prata metálica que é depositada no substrato. A eficiência das reações depende de controle do pH, concentração de nitrato de prata e temperatura. O método acídico (onde o nitrato de prata é o agente de impregnação e o formaldeído em meio alcalino é o agente redutor) e parece ser mais rápido, resultando em coloração com poucas marcações inespecíficas, servindo tanto para proteínas quanto para ácidos nucléicos. A idéia é usar baixa concentração de nitrato de prata, baixa temperatura (8-12 graus) e lavagem com tiosulfato para reduzir a cinética de redução e minimizar o background. Procedimento 1- Fixe o gel em solução de ácido acético 7,5% por 5 a 30 minutos, a depender do tamanho e espessura do gel; 2- Lave o gel por 3 vezes, cinco minutos cada, em água deionizada; 3- Mergulhe o gel em uma solução composta por AgNO3 (1,5g/L) e 0,056% de formaldeído (calcule o volume que irá usar) e deixe por 10 a 60 minutos, a depender do tamanho e espessura do gel; 4- Lave o gel em água deionizada por 20 segundos; 5- Faça a revelação em uma solução composta por Na2CO3 (30 g/L), 0,056% de formaldeído e 400 µg/L de tiosulfato de sódio. Calcule o volume que será usado e controle o tempo de revelação por observação constante; 6- Interrompa a revelação mergulhando o gel em uma solução fixadora de ácido acético 7,5% gelado, por 5 minutos; 7- Coloque o gel para secar entre duas folhas papel celofane transparente. OBS: use sempre soluções preparadas pouco antes do uso e use sempre tratamentos e lavagens com agitação constante. Concentrações mais elevadas de formaldeído provocam escurecimento das bandas. Adaptado de Caetano-Anollés and Gresshoff (1994) Página 4 de 1
Baixar