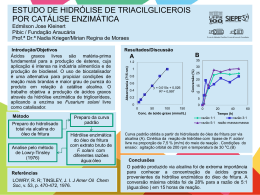
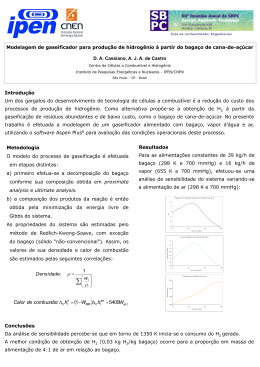
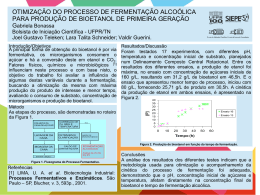
Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 ISSN 1517-8595 27 PRODUÇÃO DE BIOETANOL DE BAGAÇO DE CANA-DE-AÇÚCAR Julliana Ribeiro Alves dos Santos1, Ester Ribeiro Gouveia2 RESUMO O objetivo deste trabalho foi avaliar a produção de bioetanol a partir do bagaço de cana-deaçúcar, após pré-tratamento por explosão a vapor e hidrólise enzimática para a conversão de celulose em glicose. A hidrólise enzimática também foi realizada com material deslignificado. As fermentações foram realizadas em meios à base dos hidrolisados enzimáticos de bagaço de cana-de-açúcar a 30°C. As eficiências das hidrólises enzimáticas alcançaram 44%, independente do material utilizado. Entretanto, a hidrólise com o material deslignificado foi 30% mais rápida. A deslignificação aumentou em 10% o rendimento de bioetanol em relação à glicose e em 96% em relação ao bagaço. Palavras-chave: bagaço, hidrólise, bioetanol, Saccharomyces. BIOETHANOL PRODUCTION FROM SUGAR CANE BAGASSE ABSTRACT The aim of this work was to evaluate the production of bioethanol from sugar cane bagasse, after pre-treatment by steam explosion and enzymatic hydrolysis to convert cellulose in glucose. The enzymatic hydrolysis also was carried out with delignified material. The fermentation were carried out in the media based on hydrolysates from sugarcane bagasse at 30 ° C. The efficiencies of enzymatic hydrolysis reached 44%, regardless of the material used. However, the hydrolysis with the delignified material was 30% faster. The detoxification increased 10% the yield of bioethanol in relation to glucose and in 96% on the bagasse. Keywords: bagasse, hydrolysis, bioethanol, Saccharomyces. INTRODUÇÃO O bagaço de cana-de-açúcar, para a maior parte dos países tropicais, é um dos principais materiais lignocelulósicos utilizados para a bioconversão em etanol, uma vez que apresentam alta concentração de carboidratos, baixo conteúdo relativo de lignina, fácil utilização, baixo custo de colheita, de transporte e de armazenagem Pandey & Soccol (2000). Materiais lignocelulósicos, como o bagaço de cana-de-açúcar, são os mais abundantes complexos orgânicos de carbono na forma de biomassa de planta e consistem principalmente de três componentes: celulose, hemicelulose e lignina (Badhan et al., 2007). _______________________ Protocolo 1132 de 20/06/2008 1 Pesquisadora, Biomédica, UFPE, Departamento de Antibióticos, Av. Prof. Moraes Rêgo, Cidade Universitária, Recife-PE, [email protected], (81) 21268346 1 Professora Adjunta, Doutora em Engenharia Química, UFPE, Departamento de Antibióticos, Av. Prof. Moraes Rêgo, Cidade Universitária, Recife-PE, [email protected], (81) 21268346 28 Produção de bioetanol de bagaço de cana-de-açúcar A hidrólise enzimática desses materiais é conduzida através de enzimas celulases, que são altamente específicas. Celulases são usualmente uma mistura de diversas enzimas. Os três maiores grupos de celulases que estão envolvidas no processo de hidrólise são: endoglucanases; exoglucanases e betaglucosidase (Sun & Cheng, 2002). As celulases quebram a celulose em celobiose, que é subsequentemente clivada a glicose pela betaglucosidase (Palmqvist & Hahn-Hãgerdal, 2000). As endoglucanases agem de forma aleatória, clivando ligações beta, dentro da molécula da celulose; as celobiohidrolases (exoglucanases) remo-vem as unidades de celobiose a partir das extremidades da cadeia da celulose e a β-glicosidase quebra celobiose em duas unidades de glicose (Lima et al., 2005). Segundo Martin et al. (2006), a hidrólise é necessária para a conversão de polissacarídeos da lignocelulose a açúcares fermentescíveis. A hidrólise enzimática é conduzida em condições amenas de pH e de temperatura (pH = 4,8 e temperatura = 45-50° C) e não apresenta problemas de corrosão, como observado nas hidrólises com ácidos e/ou com bases (Duff & Murray, 1996). Entretanto, para uma eficiente hidrólise enzimática, é necessário primeiramente submeter o material lignocelulósico a um pré-tratamento, para disponibilizar a celulose ao ataque enzimático. Os processos de pré-tratamentos de materiais lignocelulósicos podem ser térmicos, químicos, físicos, biológicos ou uma combinação de todos esses, o que dependerá do grau de separação requerido e do fim proposto (Ferraz et al., 1994; Carrasco, 1992). Devido às condições empregadas nos prétratamentos térmicos e químicos, é originada uma série de compostos que podem atuar como inibidores potenciais tanto da hidrólise enzimática, quanto da fermentação. Os tipos de compostos tóxicos e suas concentrações em hidrolisados lignocelulósicos dependem tanto da matéria-prima, quanto das condições operacionais empregadas no pré-tratamento. Os produtos de degradação, que são potenciais inibidores da fermentação, se agrupam em três categorias: derivados furânicos (furfural e 5hidroximetilfurfural - HMF), ácidos orgânicos fracos (como ácido acético) e derivados fenólicos (Palmqvist & Hahn-Hãgerdal, 2000). O objetivo deste trabalho foi comparar a produção de bioetanol utilizando hidrolisados enzimáticos de dois tipos de material lignocelósico, ou seja, bagaço de cana-de- Santos & Gouveia açúcar pré-tratado por explosão a vapor com e sem deslignificação. MATERIAIS E MÉTODOS Microrganismo O microrganismo utilizado nas fermentações foi uma linhagem de levedura industrial, Saccharomyces cerevisiae UFPEDA1238, cedida pela Coleção de Culturas do Departamento de Antibióticos da Universidade Federal de Pernambuco. Meios de Cultura O meio de cultura utilizado para a conservação do microrganismo foi o meio GLP, em tubo de ensaio inclinado, contendo: glicose (20 g/L), extrato de levedura (5 g/L), peptona (3 g/L) e ágar (1,5 % P/V). Na preparação do inóculo, também foi utilizado o meio GLP, porém sem adição de ágar. Os meios de fermentação à base de hidrolisado enzimático, foram suplementados com (NH4)2SO4 (1 g/L), K2HPO4 (0,5 g/L), MgSO4.7H2O (0,25 g/L), extrato de levedura (2 g/L), peptona (1 g/L). O pH do meio de fermentação foi ajustado para 5,0. Hidrólise Enzimática Foram realizadas hidrólises enzimáticas com dois tipos de bagaço de cana-de-açúcar. Na hidrólise A, foi utilizado um bagaço pré-tratado por explosão a vapor, cedido pela Escola de Engenharia de Lorena (EEL-USP). Na hidrólise B foi utilizado este material, mas após deslignificação com NaOH. Antes de cada hidrólise, os bagaços foram submetidos à moagem no pulverizador modelo Pulverisette 14 da FRITSCH (20 mesh). Na hidrólise enzimática A, a concentração de bagaço utilizada, desde o início do processo foi de 186,16 g/L. Esta hidrólise foi realizada em frascos de erlenmeyer de 500 mL, contendo 48 mL de tampão citrato (pH = 4,8), 2 mL de preparação comercial da enzima Celluclast e 10 g de bagaço. Os frascos foram mantidos em mesa incubadora rotativa, modelo C25KC Incubator Shaker, marca New Brunswick Scientific, à 50° C e 150 rpm, durante 67 horas. Antes da hidrólise B, foi realizada a deslignificação do bagaço pré-tratado por explosão a vapor, em reator do tipo autoclave eletrônica, modelo: AU/E-20, do fabricante Regmed Indústria Técnica de Precisão Ltda. Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 Produção de bioetanol de bagaço de cana-de-açúcar Foram transferidos para o reator, 0,5 Kg do bagaço, 10 L de água destilada e 100 g de NaOH. A mistura permaneceu à 100° C, durante 1 hora, sob agitação de 100 rpm. Após a deslignificação, a polpa foi separada do licor por filtração. Foram efetuadas 7 lavagens, cada uma com 2,5 L de água destilada à 700C, para a retirada da lignina que ainda estava impregnada no material. A hidrólise B foi realizada em frascos de erlenmeyer de 500 mL, contendo 48 mL de tampão citrato 50 mM (pH = 4,8), 2mL da mesma preparação comercial de enzima utilizada na hidrólise A e 10 g de bagaço prétratado com vapor e deslignificado com NaOH. Com 24 horas de hidrólise, foram adicionados 40 mL de tampão citrato, pois o volume de tampão que foi utilizado no início da hidrólise não foi suficiente para homogeneizar a mistura. A concentração de bagaço alcançada no final da hidrólise, que durou 79 horas, foi de 105,08 g/L. No final das hidrólises A e B, cada mistura foi filtrada em papel de filtro quantitativo (de 80 g/m2; cinza 0,00005 g; permeabilidade ao ar: 3 L/s m2 e porosidade da maioria dos poros de 8 µm) para separar o hidrolisado da polpa. O hidrolisado foi novamente filtrado em membrana de 0,45µm para a quantificação de carboidratos, ácidos orgânicos, HMF, furfural e fenóis totais. Fermentações Inicialmente, a linhagem foi repicada em tubo de ensaio contendo o meio GLP sólido (pH = 7,0), o qual foi mantido a 300C durante 24 horas. Após esse período, o inóculo foi preparado através de outro repique em frasco de erlenmeyer de 250 mL contendo 50 mL de meio GLP líquido (pH = 7,0), o qual foi acondicionado a 250 rpm e a 300C, por 12 horas, em mesa incubadora rotativa da New Brunswick Scientific C25KC. A fermentação A (utilizando o hidrolisado enzimático A) foi realizada em frascos com dimensão de 8,4 cm x 2,4 cm. Um volume de 1,8 mL (10% V/V) do inóculo foram transferidos para os frascos contendo 16,2 mL do meio de fermentação, à base do hidrolisado enzimático A. Os frascos foram mantidos a 30° C, sem agitação. As fermentações utilizando o hidrolisado enzimático B foram realizadas sem (“B1”) e com (“B2”) agitação (80 rpm). Na primeira situação (B1), foram realizadas fermentações em frascos semelhantes aos da fermentação A, Santos & Gouveia 29 também a 300C. Na segunda situação (B2), foram realizadas fermentações em frascos de erlenmeyer de 125 mL, contendo 16,2 mL do meio de fermentação e 1,8 mL de inóculo, os quais foram mantidos à 30° C, sob agitação de 80 rpm em mesa incubadora rotativa da New Brunswick Scientific C25KC. Métodos Analíticos Determinação de CO2 A formação de CO2 foi determinada pela perda de peso, efetuando-se a pesagem dos frascos em balança semi-analítica da Sartorius BP3100S, após leve agitação manual durante 1 minuto. Determinação de biomassa A determinação da biomassa foi realizada por gravimetria. Um volume de 10 mL das amostras das fermentações, no início e no final das fermentações, foi filtrado em membrana de 0,45 µm, previamente pesadas em balança analítica da Sartorius BB121S. A biomassa foi seca em estufa, a 80°C, por 24 horas. Determinação de carboidratos, ácido acético, glicerol e etanol As determinações das concentrações de carboidratos, ácido acético, glicerol e etanol foram realizadas por cromatografia líquida de alta eficiência (CLAE), utilizando um cromatógrafo líquido da Agilent HP 1100. As condições cromatográficas foram: coluna Rezex ROA-Organic Acid H+ (8%), ácido sulfúrico 5 mM como fase móvel, detecção por índice de refração. Vazão de 0,6 mL/min e temperatura de 450 C foram utilizadas na determinação de carboidratos e de ácido acético. Enquanto que, vazão de 1,0 mL/min e temperatura de 300 C foram utilizadas na determinação de glicerol e de etanol (Rocha, 2000). Determinação de fenóis totais Fenóis totais foram determinados pelo método colorimétrico de Folin-Ciocalteau (Singleton et al., 1999). A 0,5 mL do hidrolisado diluído adicionaram-se 2,5 mL do reagente de Folin-Ciocalteau (10% V/V) e 2,0 mL de carbonato de sódio (7,5% P/V), incubando-se em banho termostático a 50° C, durante 5 minutos. Para a quantificação da concentração de fenóis totais foi construída uma Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 30 Produção de bioetanol de bagaço de cana-de-açúcar curva de calibração com diferentes concentrações de ácido gálico, nas mesmas condições do método colorimétrico de folinciocalteau. Determinação de hidroximetilfurfural e de furfural Para a determinação de HMF e de furfural também foi realizada por CLAE em cromatógrafo líquido da Agilent HP 1100. Foram utilizadas as seguintes condições cromatográficas: coluna C-18 (Beckman), acetonitrila 11,2% V/V e ácido acético (1%) 88,8% V/V como fase móvel, detecção UV em 274 nm, vazão de 0,8 mL/min e 25°C (Rocha, 2000). Determinação da atividade enzimática A determinação da atividade enzimática foi baseada na metodologia proposta por Ghose (1987), que mede a atividade celulolítica em termos de unidades de papel de filtro por mililitro da solução enzimática original. Os tubos de ensaios continham 50 mg do substrato (Papel de filtro quantitativo de 80 g/m2; cinza 0,00005 g; permeabilidade ao ar: 3 L/s m2 e porosidade da maioria dos poros de 8 µm), 1 mL do tampão citrato de sódio (50 mM, pH = 4,8) e 0,5 mL da enzima diluída. Os tubos controles da enzima não continham o substrato e o tubo controle do substrato não continha a enzima. Os tubos padrões de glicose continham 0,5 mL da diluição de glicose e 1 mL do tampão. Os tubos foram incubados em banho termostatizado a 50°C por 60 min. Após o período de incubação, adicionaram-se 3 mL do ácido dinitrossalicílico (DNSA) para interromper a reação enzimática. Para dosar os açúcares redutores totais os tubos foram colocados exatamente por 5 min em banho de água fervente. A leitura da absorvância foi feita em espectrofotômetro da Agilent HP 8453 a 540 nm. Usando a curva de calibração da glicose foi possível determinar a concentração de glicose liberada em cada reação enzimática. A concentração da enzima foi estimada para exatamente 2 mg de glicose liberada durante a reação enzimática (definição de Filter Paper Unity - FPU), através da equação da reta entre as concentrações de glicose após cada reação e os logaritmos das respectivas diluições da enzima. Santos & Gouveia RESULTADOS E DISCUSSÃO Hidrólise enzimática do material sem e com deslignificação Antes de realizar as hidrólises enzimáticas, foi necessário medir a atividade da preparação enzimática comercial para poder calcular as quantidades de enzima que seriam utilizadas nas hidrólises. A atividade enzimática (AE) da enzima Celluclast utilizada nas hidrólises enzimáticas foi igual a 86,14 FPU/mL. A partir do resultado da atividade enzimática, foi possível calcular a quantidade necessária de enzima para as hidrólises, considerando que a dosagem de enzima comumente utilizada nas hidrólises está entre 7 e 33 FPU/g substrato (Sun & Cheng, 2002). Neste trabalho foram utilizados 17,2 FPU/g de bagaço. Entretanto, após 46 horas, foram adicionados mais 2 mL da enzima na hidrólise B, uma vez que a conversão de celulose em glicose já tinha alcançado o mesmo valor encontrado para a conversão com o material não deslignificado (hidrólise A). Supunha-se que se aumentando a quantidade de enzima poderia aumentar a conversão, entretanto, após mais 33 horas, a conversão manteve-se constante. O cálculo da eficiência de hidrólise foi obtido a partir da quantidade de glicose formada (Tabela 1), que foi convertida em celulose pela multiplicação por 0,9 (Rocha, 2000), bem como pelo conhecimento dos teores de celulose nas polpas de bagaço com (85,6 %) e sem deslignificação (49,9%), utilizadas nas hidrólises enzimáticas. Tabela 1. Composição dos hidrolisados enzimáticos Componente (g/L) Glicose Xilose Fenóis totais Ácido acético A B 44,11 2,32 0,77 0,30 45,65 0,77 0,09 0,005 Martin et al. (2002) 23,5 9,0 4,1 4,0 As eficiências das hidrólises enzimáticas alcançaram valores de aproximadamente 44% em ambos os casos. No caso da hidrólise B, foi encontrado este valor com apenas 46 horas, mantendo-se assim até 79 horas. Entretanto, a presença de lignina provavelmente diminuiu o acesso das enzimas ao substrato, quando se utilizou o material não deslignificado (hidrólise A). Dessa forma, o processo foi mais lento que Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 Produção de bioetanol de bagaço de cana-de-açúcar aquele observado quando foi utilizado o material deslignificado (hidrólise B). Por outro lado, a presença de lignina não foi o fator limitante da hidrólise enzimática B, mas, provavelmente a alta concentração de glicose com 46 horas, que pode ter inibido a ação das celulases. A atividade das endoglucanases é inibida pela celobiose e menos extensivamente pela glicose. As enzimas beta-glucosidases são inibidas pela glicose (Phlipidis et al., 1993). Sun & Cheng (2002) sugeriram diversos métodos que têm sido desenvolvidos para reduzir a inibição, incluindo a suplementação de beta-glucosidases, durante a hidrólise, e a remoção de açúcares durante a hidrólise, através da ultrafiltração. Na Tabela 1, observam-se as composições dos hidrolisados A, B e de um hidrolisado de bagaço de cana-de-açúcar obtido por Martin et al. (2002). No presente trabalho, não foram encontradas quantidades detectáveis de furfural e de HMF. Isso provavelmente ocorreu devido o material lignocelulósico ter sido exaustivamente lavado após o tratamento por explosão a vapor e após a deslignificação. No hidrolisado obtido por Martin et al. (2002), além dos compostos apresentados na Tabela 1, também foram encontrados compostos furânicos (furfural 1,1 g/L; HMF 0,2 g/L). Os hidrolisados enzimáticos A e B apresentaram concentrações de xilose, ácido acético e fenóis muito menores que àquelas encontradas por Martin et al. (2002), quando realizaram hidrólise com bagaço de cana-deaçúcar também pré-tratado por explosão à vapor. Comparando-se os hidrolisados A e B, observa-se que houve uma redução de 88% de fenóis, de 98% de ácido acético e de 67% de xilose, quando o material foi deslignificado. Martin et al. (2002), quando realizaram um tratamento químico de deslignificação com Ca(OH)2, encontraram reduções de 80% e 18%, para fenóis e ácido acético, respectivamente. Esses autores não encontraram redução no teor de xilose. Saccharomyces cerevisiae apresenta uma única desvantagem que é a incapacidade de metabolizar xilose (Jeffries & Shi, 1999; HahnHägerdal et al., 2001). Entretanto, em concentração de 3 g/L de xilose, não foi observado queda no rendimento em etanol em fermentações utilizando a mesma levedura do presente trabalho (Santos & Gouveia, 2007). Dentre os inibidores da fermentação identificados nos hidrolisados dos materiais Santos & Gouveia 31 lignocelulósicos, os compostos fenólicos, gerados a partir da degradação da lignina, são os mais tóxicos (Palmqvist & Hahn-Hãgerdal, 2000). Como na hidrólise B foi utilizado um material deslignificado, quantidade muito pequena de fenóis totais foi encontrada. Fermentações dos hidrolisados enzimáticos Após a obtenção dos hidrolisados enzimáticos A e B, os mesmos foram utilizados na preparação dos meios das fermentações, denominadas de A e B, respectivamente. As fermentações foram realizadas em duplicata e as amostras foram retiradas no início e no final de cada fermentação. O acompanhamento da formação de CO2, por perda de peso, além da observação visual de espuma (Foto 1), serviu para estimar o tempo final da fermentação. O perfil de CO2 (g) em todas as fermentações foi crescente até 17 horas. Entretanto, nas fermentações B (hidrolisado de polpa com deslignificação), os valores de CO2 foram aproximadamente 4 vezes maiores que àqueles observados nas fermentações A (hidrolisado enzimático de polpa sem deslignificação). Na fermentação A (Tabela 2), observou-se uma menor produção de biomassa, provavelmente, porque nesta fermentação foi utilizado um hidrolisado enzimático que continha uma maior concentração de compostos fenólicos, uma vez que ácidos orgânicos fracos diminuem a produção de biomassa, mas somente a partir de concentrações maiores que 6 g/L (Palmqvist & Hahn-Hãgerdal, 2000). Foto 1. Fermentações com o hidrolisado B sem agitação. A maior produção de biomassa e o maior rendimento (YX/G) ocorreram na fermentação B2. A oxigenação favoreceu a formação de materiais necessários à produção de biomassa. Em aerobiose, o açúcar é transformado em biomassa, CO2 e água, e, em anaerobiose, a maior parte é convertida em etanol e CO2 (Lima et al., 2001). Os rendimentos em biomassa (YX/G) concordam com aqueles obtidos por Martin et al. (2002), Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 Produção de bioetanol de bagaço de cana-de-açúcar 32 para material sem e com deslignificação. Esses autores também obtiveram maiores rendimentos Santos & Gouveia em biomassa deslignificado. quando utilizaram material Tabela 2. Resultados das fermentações com os hidrolisados sem e com deslignificação. Fermentação Gc Ed YE/G Xe YX/G YE/B (g/L) (g/L) (g/g) (g/L) (g/L) (g/g) A 32,8 9,5 0,29 0,24 0,007 0,051 Martina 20,8 6,0 0,29 0,61 0,002 0,10 B1 34,1 10,8 0,32 1,07 0,031 0,10 B2 34,2 9,1 0,27 1,89 0,055 0,09 Martinb 20,8 9,5 0,46 1,43 0,067 0,16 a Fermentação de hidrolisado não deslignificado Fermentação de hidrolisado deslignificado Glicose, d Etanol e Biomassa b c Com relação à produção de bioetanol, houve um aumento de cerca de 10% no rendimento em etanol (YE/G) da fermentação no hidrolisado B1 (0,32 g/g), em relação ao hidrolisado A (0,29 g/g). Por outro lado, na fermentação com agitação (B2), o rendimento foi inferior àquele obtido na fermentação com o hidrolisado sem deslignificação (A). O rendimento em etanol em relação ao bagaço utilizado (YE/B) também foi maior nas fermentações com deslignificação. Na verdade, observa-se um aumento de 96%, entre os resultados da fermentação A (0,051 g etanol/ g bagaço seco ) e da fermentação B (0,1-0,09 g etanol/ g bagaço seco). Comparando-se os resultados obtidos durante a fermentação B1 com os resultados obtidos por Martin et al. (2002), utilizando um material também deslignificado, observa-se que estes autores encontraram um rendimento de etanol em relação ao bagaço, 60 % maior, provavelmente por terem utilizado uma levedura recombinante capaz de metabolizar xilose, uma vez que o material continha alta concentração deste açúcar (Tabela 1). Por outro lado, o rendimento de 0,10 g etanol/g bagaço obtido na fermentação B1 foi igual àquele obtido por Martin et al. (2002), quando utilizaram material não deslignificado. CONCLUSÕES A presença de lignina na hidrólise do material não deslignificado foi um fator limitante ao acesso das enzimas e, conseqüentemente, a presença de compostos fenólicos provenientes da presença de lignina no hidrolisado A, desfavoreceu a produção de bioetanol. Por outro lado, a deslignificação aumentou em 10% o rendimento de etanol em relação à glicose e em 96% em relação ao bagaço. AGRADECIMENTOS Os autores agradecem à FINEP (Financiadora de Estudos e Projetos) e à FACEPE (Fundação de Amparo à Ciência e Tecnologia do Estado de Pernambuco) pelo apoio financeiro. REFERÊNCIAS BIBLIOGRÁFICAS Badhan, A.K.; Chadha, B.S.; Kaur, J.; Saini, H.S.; Bhat, M.K. Production of multiple xylanolytic and cellulolytic enzymes by thermophilic fungus Myceliophthora sp. IMI 387099. Bioresource Technology, v. 98, p. 504510, 2007. Carrasco, F. Thermo-mechano-chemical pretreatment of wood in a process development unit. Wood Science and Technology, v. 26, p. 413-428, 1992. Duff, S.J.B.; Murray, W.D. Bioconversion of forest products industry waste cellulosics to fuel ethanol: a review. Bioresource Technology, v.55, p.1–33, 1996. Ferraz, A.; Mendonça, R.; Cotrim, A.R.; Silva, F.T. The use of white-rot decaying as a pretreatment for organosolv delignification of Eucalyptus grandis wood. Wokshop on Applications of Biotechnology in Bioenergy Systems, Anais…1994, Ottawa, Canadá. Ghose, T. K. Measurement of cellulase activities. New Delhi: Indian Institute of Technology, 1987. Hahn-Hagerdal, B.; Wahlbom, C.F.; Gardonyi, M.; Van Zyl, W.H.; Cordero Otero, R.; Jonsson, L.J. Metabolic engineering of Saccharomyces cerevisiae for xylose Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 Produção de bioetanol de bagaço de cana-de-açúcar utilisation. Advances in Biochemical Engineering Bio-technology, v. 73, p. 53– 84, 2001. Jeffries, T.W.; Shi, N.Q. Genetic engineering for improved xylose fermentation by yeasts. Advances in Biochemical Engineering Bio-technology, v. 65, p. 117–161, 1999. Lima, U.A.; Basso, L.C.; Amorim, H.V., Produção de etanol. In: Lima, U.A.; Aquarone, E.; Borzani, W.; Schmidell, W. (Ed.) Biotecnologia Industrial, São Paulo: Edgard Blücher LTDA, 2001, cap. 1, p. 1120. Martín, C.; Galve, M.; Fredrik Wahlbom, C.; Hagerdal, B.H.; Jonsson, L.J. Ethanol production from enzymatic hydrolysates of sugarcane bagasse using recombinant xilose –utilising Saccharomyces cerevisiae. Enzyme and Microbial Technology, v. 31, p. 274-282, 2002. Martín, C.; Marcet, M.; Almazán, O.; Jonsson, L.J. Adaptation of a recombinant xyloseutilizing Saccharomyces cerevisiae strain to a sugarcane bagasse hydrolysate with high content of fermentation inhibitors. Bioresource Technology, v. 98, p. 17671773, 2006. Palmqvist, E.; Hahn-Hagerdal, B. Fermentation of lignocellulosic hydrolysates I: inhibition and detoxification. Bioresource Technology, v. 74, p. 17-24, 2000. Santos & Gouveia 33 Pandey, A.; Soccol, C.R. Economic utilization of crop residues for value addition: a futuristic approach. Journal of Scientific & Industrial Research, v. 59, p. 12–22, 2000. Philippidis, G.P.; Smith, T.K.; Wyman, C.E. Study of the enzymatic hydrolysis of cellulose for production of fuel ethanol by the simultaneous saccharification and fermentation process. Biotechnology and Bioengineering, v. 41, p. 846–853, 1993. Rocha, G.J.M. Deslignificação de bagaço de cana-de-açúcar assistida por oxigênio. São Carlos: USP, 2000, 136 p. Santos, J.R.A.; Gouveia, E.R. Produção de Etanol por Três Linhagens Industriais de Saccharomyces cerevisiae na Presença de Xilose. XVI Simpósio Nacional de Bioprocessos, 2007, Anais..... Curitiba: UFPA, 2007 (CD ROM). Singleton, V.; Orthofer, R.; LamuelaRavento´S, R. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteau reagent. Methods in Enzymology, v. 299, p. 152– 178, 1999. Sun, Y.; Cheng, J. Hidrolysis of lignocellulosic materials for ethanol production: a review. Bioresource Technology, v.83, p.1-11, 2002. Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.27-33, 2009 34 Revista Brasileira de Produtos Agroindustriais, Campina Grande, v.11, n.1, p.34, 2009
Download