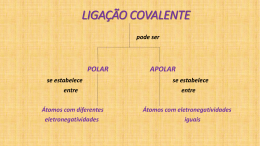
Colégio São Paulo-Teresópolis/RJ Projeto Sabadão Química Raquel Berco •Ligações químicas: são constituídas de elétrons. •Devemos respeitar a regra do octeto. Regra do Octeto : todo elemento tende a se estabilizar com a configuração eletrônica do gás nobre mais próximo (8 elétrons na última camada). 1. Ligação Iônica ou Eletrovalente Ocorre através da transferência de elétrons ocasionando a atração entre os íons formados. Em geral → Metal + Ametal Propriedades Físicas dos Compostos Iônicos: Elevados PF e PE (sólidos T ambiente) Condução eletricidade quando fundidos ou solução aquosa Forma agregado iônico; não forma molécula 2. Ligação Covalente ou Molecular Ocorre através do compartilhamento de elétrons. OBS: Ligação Covalente Coordenada ou DATIVA Após completar sua camada de valência, um átomo pode emprestar um ou mais pares de elétrons desemparelhados (que não estejam em uso) a outro átomo, de modo completa-lo. Propriedades Físicas dos Compostos Covalentes (Moleculares) P.F e P.E baixos Alguns são capazes de conduzir corrente elétrica em solução aquosa (ionizados) Apresentam-se nos estados sólido, líquido e gasoso. 3. Ligação Metálica Os elétrons dos metais podem circular no retículo metálico de modo manter unidos os cátions metálicos (Teoria do Mar de Elétrons). É a mais forte das ligações. Não forma molécula ou agregado iônico, mas retículo metálico. A representação dos metais e ligas metálicas é feita apenas pelos símbolos dos elementos presentes. Ex: ferro - Fe Liga Ouro 18k (ouro; prata e cobre) - AuAg-Cu Propriedades Físicas dos Compostos Metálicos Possuem elevados P.F e P.E São sólidos à temperatura ambiente (exceto Hg) Excelentes condutores de calor e eletricidade Caráter das Ligações Quanto maior a diferença entre as eletronegatividades(∆E) dos átomos envolvidos, mais polar será a ligação, acentuando o caráter iônico da mesma. POLARIDADE DAS LIGAÇÕES O que determina o tipo de ligação entre dois átomos é a diferença de eletronegatividade entre eles. Quanto maior a diferença de eletronegatividade maior é o caráter iônico da ligação ou quanto menor a diferença de eletronegatividade maior o caráter covalente da ligação. Temos na tabela a eletronegatividade de cada elemento segundo Linus Pauling: A polaridade de uma ligação surge através da diferença de eletronegatividade. Exemplo 1: Cl-Cl ∆E = 3 - 3 = 0 Como a diferença de eletronegatividade é igual a zero temos uma ligação 100% covalente denominada - Ligação Covalente Apolar. Exemplo 2: H - Cl ∆E = 3,0 - 2,1 = 0,9 Ligação Covalente Polar. Resumindo: Temos uma ligação covalente polar se no composto molecular, entre os elementos ligados, houver diferença de eletronegatividade. Temos uma ligação covalente apolar se não houver diferença de eletronegatividade entre os átomos ligados. A geometria molecular explica como estão dispostos os átomos dentro da molécula. Quando temos uma molécula diatômica (apenas dois átomos) não há outra disposição possível que não seja num ângulo de 180°, ou seja, a molécula é linear(X2ou XY). H2 : H – H G: Linear - Apolar HCl : H - Cl G:Linear - Polar Outras geometrias moleculares: Fórmula Molecular XY2 XY3 XY4 Pares eletrônicos livres do átomo central Geometria molecular Polaridade Ausência Linear Apolar Presença Angular Polar Ausência Trigonal Plana Apolar Presença Piramidal Polar Ausência Tetraédrica Apolar Obs.: Se houver a presença de pelo menos 1 Y diferente, a molécula deixa de ser apolar e fica Polar. Linear: Angular: Trigonal Plana: Tetraédrica: Piramidal: Exercícios: 1.(Ita 2013) Os átomos A e B do segundo período da tabela periódica têm configurações eletrônicas da camada de valência representadas por ns2np3 e ns2np5, respectivamente. Com base nessas informações, são feitas as seguintes afirmações para as espécies gasosas no estado fundamental: I. O átomo A deve ter maior energia de ionização que o átomo B. II. A distância da ligação entre os átomos na molécula A2 deve ser menor do que aquela na molécula B2. III. A energia de ionização do elétron no orbital 1s do átomo A deve ser maior do que aquela do elétron no orbital 1s do átomo de hidrogênio. IV. A energia de ligação dos átomos na molécula B2 deve ser menor do que aquela dos átomos na molécula de hidrogênio (H2). Das afirmações acima está(ão) CORRETA(S) apenas a) I, II e IV. d) III e IV. b) I e III. e) IV. c) II e III. 3. (Ibmecrj 2013) O ácido sulfídrico é um gás que se forma da putrefação natural de compostos orgânicos. Por ser assim, é um gás incolor, tóxico e corrosivo. Esse ácido se forma da união de enxofre e hidrogênio. Indique a opção correta quanto a sua fórmula molecular e o tipo de ligação que está ocorrendo: a) H2S, ligação iônica b) H2S, ligação covalente c) HS2, ligação iônica d) HS2, ligação covalente e) H2S, ligação metálica 4. (Uepg 2013) Considerando-se os elementos químicos e seus respectivos números atômicos e assinale o que for correto. 01) No composto encontra-se uma ligação covalente polar. 02) No composto encontra-se uma ligação iônica. 04) No composto encontra-se uma ligação covalente polar. 08) No composto encontra-se uma ligação covalente apolar. 5. (Udesc 2013) Os tipos de ligações químicas dos compostos: são, respectivamente: a) covalente polar, covalente polar, iônica, covalente apolar, iônica. b) covalente apolar, iônica, covalente polar, covalente apolar, iônica. c) covalente apolar, covalente polar, iônica, covalente apolar, iônica. d) covalente polar, covalente apolar, iônica, covalente polar, iônica. e) covalente polar, covalente apolar, iônica, covalente apolar, covalente polar. 11. (Udesc 2011) No cloreto de amônio estão NH4Cl presentes: a) 3 ligações covalentes dativas e 1 ligação iônica. b) 4 ligações iônicas e 1 ligação covalente dativa. c) 2 ligações covalentes normais, 2 ligações covalentes dativas e 2 ligações iônicas. d) somente ligações iônicas. e) 4 ligações covalentes e 1 ligação iônica. 1. (Ufg 2014) Considerando-se o modelo de repulsão dos pares de elétrons da camada de valência (do inglês, VSEPR), as moléculas que apresentam geometria linear, trigonal plana, piramidal e tetraédrica são, respectivamente, a) SO2, PF3, NH3 e CH4 b) BeH2, BF3, PF3 e SiH4 c) SO2, BF3, PF3 e CH4 d) CO2, PF3, NH3 e CCl4 e) BeH2, BF3, NH3 e SF4 6. (cftmg 2013) Considere o conjunto de substâncias químicas: BeH2, BF3, H2O, NH3 e CH4. O número de substâncias com geometria trigonal plana é igual a a) 0. c) 2. b) 1. d) 3. 14. (cftmg 2010) A disposição espacial de uma molécula pode ser prevista utilizando-se a teoria da repulsão dos pares eletrônicos da camada de valência. Com base nessa teoria, associe cada molécula a sua respectiva geometria. A sequência correta encontrada é a) 5, 2, 3 e 4. b) 2, 1, 5 e 4. c) 1, 5, 4 e 3. d) 1, 2, 3 e 5. 15. (Unifesp 2009) Na figura, são apresentados os desenhos de algumas geometrias moleculares. SO3, H2S e BeCℓ2 apresentam, respectivamente, as geometrias moleculares: a) III, I e II. d) IV, I e II. b) III, I e IV. e) IV, II e I. c) III, II e I. FIM!!!! BONS ESTUDOS!!!!
Baixar