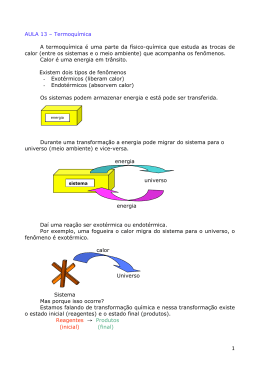
Estuda as reações químicas e as mudanças de estado físico que envolvem trocas de energia na forma de calor. Entre esses processos, temos basicamente dois: Processos endotérmicos e exotérmicos A queima do palito de fósforo corresponde a uma reação exotérmica com liberação de calor Processos exotérmicos: São aqueles em que ocorre a liberação do calor para o meio. Reagentes → Produtos + calor ∆H = HP - HR (HP < HR) ∆H < 0 Reagentes → Produtos ∆H < 0 Graficamente: Entalpia (H) HR Reagentes ∆H < 0 HP Produtos Caminho da reação Todos os processos de combustão são reações exotérmicas. Combustão do etanol e da gasolina Queima do carvão Passagem do estado de vapor de água para o líquido (condensação) Formação da neve (água líquida se solidifica – solidificação) Combustão de alguns gases (entre eles o propano) no bico de Bunsen Bolsa de aquecimento Respiração Queima de alimentos, fornecendo para o nosso organismo (na imagem é mostrado um rótulo com a quantidade de calorias do alimento) Queima da palha de aço São equeles em que ocorre a absorção do calor Reagentes + calor → Produtos ∆H = HP - HR (HP > HR) ∆H > 0 Reagentes → Produtos ∆H > 0 Os gráficos dos processos endotérmicos ficam com o seguinte aspecto: Entalpia (H) Produtos HR ∆H > 0 HP Reagentes Caminho da reação Fe2O3(s) + 3 C(s) → 2 Fe(s) + 3 CO(g) Entalpia (H) 2Fe(2)+ 3 CO(g) HR ∆H = -491,5 kJ HP Fe2O3(s) + 3 C(s) Caminho da reação ∆H = + 491,5 kJ Fotossíntese (na energia fornecida pelo sol é absorvida pelas plantas) Fusão para o gelo derreter (passar do estado sólido para o líquido) ele precisa absorver calor do meio. Evaporação A água líquida absorve calor para passar para o estado de vapor (imagem: roupas secando no varal) Bolsa de gelo instantâneo a) a) H2O(l) → H2(g) 1/2 O2(g) ΔH = +68,3 Kcal b) CO2(g) → C(grafite) + O2(g) ΔH = +94,1 Kcal c) 2C(grafite) + 3 H2(g) → C2H6(g) ΔH = -20,5 Kcal 1) A figura abaixo representa a mudança de estado físico da água: Classifique cada mudança de estado em endotérmica ou exotérmica. II. Em uma cozinha, estão ocorrendo os seguintes processos: I. gás queimando em uma das “bocas” do fogão e II. água fervendo em uma panela que se encontra sobre esta “boca” do fogão. Com relação a esses processos, pode-se afirmar que: a) I e II são exotérmicos. b) I é exotérmico e II é endotérmico. c) I é endotérmico e II é exotérmico. d) I é isotérmico e II é exotérmico. e) I é endotérmico e II é isotérmico. ADVINHA O QUE É? ADVINHA O QUE É?
Baixar