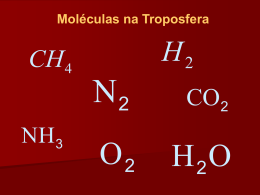
Constituição atómica da matéria. Condutores Isoladores Semicondutores 1 http://www.prof2000.pt/users/lpa Constituição da matéria A matéria que se pode encontrar no estado sólido, liquido ou gasoso é constituída por moléculas e estas podem ainda ser subdivididas em partículas menores que são os átomos. Exemplo: 1 molécula de água H2O 2 2 átomos de hidrogénio H2 1 átomo de oxigénio + O Estrutura do átomo O átomo é basicamente formado por três tipos de partículas elementares: electrões, protões e neutrões. Órbita electrónica 3 Os protões e os neutrões estão no núcleo do átomo e os electrões giram em órbitas electrónicas à volta do núcleo do átomo. Carga eléctrica das partículas A carga eléctrica do electrão é igual à carga do protão, porém de sinal contrário: o electrão possui carga negativa (-) e o protão carga eléctrica positiva (+). O neutrão não possui carga eléctrica, isto é, a sua carga é nula. 4 Órbitas electrónicas Num átomo, os electrões que giram em volta do núcleo distribuem-se em várias órbitas ou camadas electrónicas num total máximo de sete (K, L, M, N, O, P, Q). 5 Carga eléctrica do átomo Em qualquer átomo, o número de protões contidos no seu núcleo é igual ao número de electrões que giram à volta dele, ou seja, a carga eléctrica do átomo é nula, pois a carga positiva dos protões é anulada pela carga negativa dos electrões. Um átomo nesse estado está electricamente neutro. 6 Iões positivos e iões negativos Um átomo quando electricamente neutro poderá ganhar (receber) ou perder (ceder) electrões. Quando ele ganha um ou mais electrões, dizemos que se transforma num ião negativo. Quando um átomo perde um ou mais electrões, dizemos que ele se transforma num ião positivo. Exemplo: Se o átomo de sódio (Na) ceder um electrão ao átomo de cloro (Cl) passamos a ter um ião positivo de sódio e um ião negativo de cloro. Ião negativo de cloro 7 Cl - N+ a Ião positivo de sódio Electrões de valência A órbita electrónica ou camada mais afastada do núcleo é a camada de valência e os electrões dessa camada são chamados de electrões de valência. Electrão de valência 8 Num átomo, o número máximo de electrões de valência é de oito. Quando um átomo tem oito electrões de valência diz-se que o átomo tem estabilidade química ou molecular. Condutores Os átomos com 1, 2 ou 3 electrões de valência têm uma certa facilidade em cedê-los já que a sua camada de valência está muito incompleta (para estar completa deveria ter 8 electrões de valência). Por exemplo, um átomo de cobre tem um electrão de valência o que faz com que ele ceda com muita facilidade esse electrão (electrão livre). Número atómico do cobre = 29 (número total de electrões no átomo) K=2 L=8 M=18 N=1 9 2n2 = 2x12 = 2 2n2 = 2x22 = 8 2n2 = 2x32 = 18 29P K L M N Isoladores Os átomos que têm entre 5 e 8 electrões de valência não cedem facilmente electrões já que a sua camada de valência está quase completa (para estar completa deveria ter 8 electrões de valência). O vidro, a mica, a borracha estão neste caso. Estes materiais não são condutores da corrente eléctrica porque não têm electrões livres sendo necessário aplicarlhes uma grande energia para passar os electrões de banda de valência para a banda de condução. 10 Semicondutores Número atómico do Germânio: 32 Número atómico do Silício: 14 Os átomos com 4 electrões de valência geralmente não ganham nem perdem electrões, é o que acontece com os materiais semicondutores, Germânio (Ge) e Silício (Si). 11 Bandas de energia Energia 12 Num material isolante é necessário aplicar muita energia (por exemplo, muita tensão eléctrica) para passar os electrões da banda de valência para a banda de condução já que a banda proibida é muito larga. Pelo contrário, num material condutor a passagem dos electrões da banda de valência para a banda de condução faz-se facilmente já que não existe banda proibida. Os materiais semicondutores estão numa situação intermédia entre os materiais isoladores e condutores.
Baixar